
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为 Mno2+4Hcl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制各CO,已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ/mol、-285.8kJ/mol和-283.0 kJ/mol,则生成1 m3(标准状况)CO所需热量为__________;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为________________;
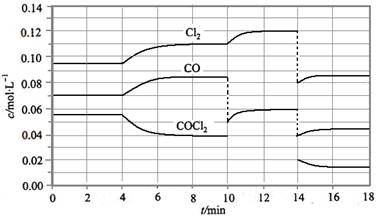
(4)COCl2的分解反应为COCl2(g) === Cl2(g) + CO(g) △H = +108 kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线来示出):
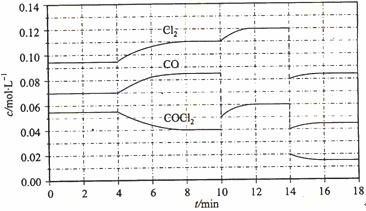
①计算反应在第8 min时的平衡常数K = __________
②比较第2 min反应温度T(2)与第8 min反应温度(T8)的高低:T(2)____T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2) = ______mol/L;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以![]() (2—3)、
(2—3)、![]() (5—6)、
(5—6)、![]() (l2-13)表示]的大小____________;
(l2-13)表示]的大小____________;
⑤比较反应物COCl2在5-6 min和15-16 min时平均反应速率的大小:
![]() (5-6) >
(5-6) >![]() (15-16)(填“<”、“>”或“=”),原因是_______________。
(15-16)(填“<”、“>”或“=”),原因是_______________。
答案:

解析:此题中挡题,拿满分较难(不过第四问中的①③的答案确实有待商榷,为什么都要保留到小数点后三位,从题目中能看出来吗?)体现在计算麻烦上,第二问其实出题人完全直接说甲烷的燃烧热为890.3kJ/mol,…这样很多同学在计算反应热的时候更容易错。因为反应为CH4+CO2=2CO+2H2 △H=反应物的燃烧热-产物的燃烧热=247.3 KJ/mol,也就是生成2mol CO,需要吸热247.3 KJ,那么要得到1立方米的CO,放热为(1000/22.4)×247.3/2=5.52×103 KJ.第三问要根据电负性分析碳元素化合价的变化,CHCl3碳为+2价,COCl2中碳为+4价,即可写出方程式。第四问,①根据K计算公式即可求出,但是答案为什么只保留三位小数值得商榷,②同时计算T2时的K值很明显小于T8时的K值,说明是升高温度平衡正向移动的原因。③题目说了是不同条件下的平衡状态,那么后面温度就不会改变。根据K值可计算C(COCl2).④因为5-6分钟,CO浓度在改变所以平均反应速率大于其它的,因为处于平衡状态,根据V的计算公式,2-3、12-13的平均反应速率为0。⑤因为5-6分钟时浓度改变大于12-13。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2012-2013学年辽宁省葫芦岛一高高二上学期第一次月考化学试卷(带解析) 题型:填空题
光气(COCl2)在塑料等工业中有许多用途,COCl2的分解反应为:COCl2(g)  Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如大图(每次仅改变一个条件):
Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如大图(每次仅改变一个条件):
①比较第2 min 反应温度T(2)与第8 min反应温度T(8)的高低:T(2) T(8)
②比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率
[分别以v(2~3)、v(5~6)、v(12~13)表示]的大小
③比较第14min时,使平衡移动采取措施可以是
④比较第8 min和第16min时,平衡常数K值(分别用K8,K16表示)大小关系是
⑤COCl2在达平衡时的转化率中最大的是第 min(范围)
⑥计算出第4min之后再达平衡的混合气体中,平均相对分子质量最大数值是 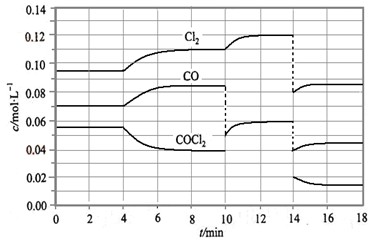
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学三轮复习排查 专题6化学反应速率和化学平衡练习卷(解析版) 题型:填空题
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
已知COCl2(g)  Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
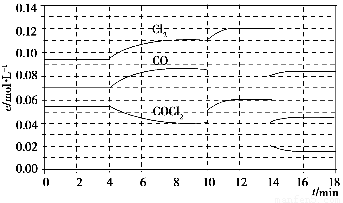
(1)化学平衡常数表达式K=________,计算反应在第8 min时的平衡常数K=________;
(2)比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
(3)若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________;10~12 min内CO的平均反应速率为v(CO)=________;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率(平均反应速率分别以v(2~3)、v(5~6)、v(12~13))的大小________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省赣州市高三上学期期末联考理综化学试卷(解析版) 题型:填空题
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)氯气工业上来源于氯碱工业,氯碱工业的化学方程式为
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO和H2,已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ/mol、-285.8kJ/mol和-283.0 kJ/mol,则该反应的热化学方程式为:_____ _____;
(3)COCl2的分解反应为COCl2(g)
 Cl2(g) + CO(g) △H
= +108 kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线来示出):
Cl2(g) + CO(g) △H
= +108 kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线来示出):
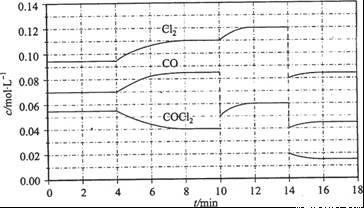
①计算反应在第8 min时的平衡常数K = __________(保留小数点后两位数字)
②比较第2 min反应温度T(2)与第8 min反应温度(T8)的高低:T(2)____T(8)(填“<”、 “>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2) = ______mol/L;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以V(2—3)、 V(5—6)、 V(l2-13)表示]的大小____________;
⑤反应物COCl2在5-6 min和15-16 min时平均反应速率的大小为:V(5-6) > V(15-16),原因是__ _____________。
查看答案和解析>>
科目:高中化学 来源:2014届河南安阳一中高二月考(奥数班)化学试卷(解析版) 题型:填空题
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
COCl2的分解反应为COCl2(g) 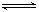 Cl2(g) + CO(g) △H = + 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14
min的COCl2浓度变化曲线未画出):
Cl2(g) + CO(g) △H = + 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14
min的COCl2浓度变化曲线未画出):
(1) 计算反应在第8 min 时的平衡常数K = ;
(2) 比较第2 min 反应温度T(2)与第8 min反应温度T(8)的高低:T(2) T(8)(填“<”、“>”或“=”);
(3) 若12 min 时反应于温度T(8)下重新达到平衡,则此时c(COCl2) = mol·l-1;
(4) 比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小 ;
(5)比较反应物COCl2在5~6 min和15~16 min时平均反应速率的大小v(5~6) v(12~13) (填“<”、“>”或“=”),原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com