
【题目】下列有关物质熔点的比较中,不正确的是( )
A. Na大于 KB. CO2大于SiO2
C. MgO大于Na2OD. 金刚石大于晶体硅
科目:高中化学 来源: 题型:
【题目】将铜加入一定量稀硫酸和过氧化氢混合溶液中,充分反应后,溶液呈蓝色,有无色气体产生;若还发现容器底部有少量固体,则该固体可能是( )
A.Cu
B.S
C.CuS
D.Cu2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素,按照原子半径依次减少,第一电离能依次增大的顺序排列的是( )
A. Ca、Mg、BeB. Na、Mg、AlC. C、N、OD. P、S、Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构的叙述正确的是( )
A.在离子化合物中不可能存在非极性共价键
B.由电子定向移动而导电的物质一定是金属晶体
C.有键能很大的共价键存在的物质熔沸点一定很高
D.只含有共价键的物质不一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有下列外围电子排布式的基态原子中,能形成AB2型离子化合物的是( )
A. 2s22p2与2s22p4B. 3s23p4与2s22p4
C. 3s2与3s23p1D. 3s2与2s22p5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】和碳同一主族的硅原子中能量最高的电子处在电子层上(填写电子层符号),最外层有种运动状态不同的电子,碳原子核外有种能量不同的电子,有种不同形状的电子云.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按纯净物、胶体、电解质、氧化物的顺序组合的一组为( )
A. 稀盐酸、氨水、硫酸、干冰
B. 蒸馏水、淀粉溶液、碳酸氢钠、二氧化硫
C. 胆矾、雾、铁、石膏
D. 生石灰、泥水、氯化铜、碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Mg、P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,请回答下列问题。
(1)基态Mg原子L层电子排布式为_____,P、S、Cl的第一电离能由大到小顺序为_______。
(2)PH4Cl的电子式为_________,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为__________。
(3)SCl2分子中的中心原子杂化轨道类型是_______,该分子构型为_________。
(4)已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69 pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_____________。
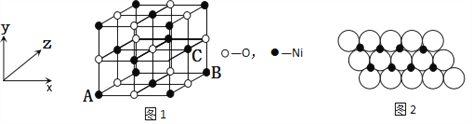
(5)如图1所示,NiO晶胞中离子坐标参数A为(0,0,0),B为(1,0,1),则C离子坐标参数为___________。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为______g。(用a、NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=______________.
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量______________.
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=_____________.
(4)达到平衡时,N2和H2的转化率之比,α(N2):α(H2)=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com