
【题目】下列说法正确的是( )
A.国产大飞机C919用到的氮化硅陶瓷属于新型无机非金属材料
B.用pH试纸测得氯水的pH为2
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.铝和重氢氧化钠的![]() 溶液反应的化学方程式:2Al+2NaOD+2
溶液反应的化学方程式:2Al+2NaOD+2![]() 2O=2NaAlO2+D2↑+
2O=2NaAlO2+D2↑+![]() 2↑
2↑
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用图实验装置,能得出相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓醋酸 | CaCO3 | C6H5ONa | 酸性:醋酸>碳酸>苯酚 | |
B | Br2的苯溶液 | 铁屑 | AgNO3 | 苯和溴单质在铁催化剂作用下发生取代反应 | |
C | 浓硫酸 | 乙醇 | KMnO4 | 发生消去反应生成乙烯 | |
D | 硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)空气电池的工作原理如图所示。下列说法正确的是( )
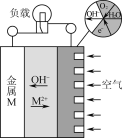
A.金属M作电池正极
B.电解质是熔融的MO
C.电路中转移2 mol电子,理论上约消耗空气56 L
D.电池总反应为2M+O2+2H2O=2M(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:

(1)从反应开始到10 s时,用Z表示的反应速率为 ,X的物质的量浓度减少了 ,Y的转化率为 。
(2)该反应的化学方程式为
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:

则下列说法符合该图像的是 。
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理对研究部分单质及其化合物的反应有重要意义。
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成是目前普遍使用的人工固氮方法:N2(g)+3H2(g)![]() 2NH3(g)。请回答:
2NH3(g)。请回答:
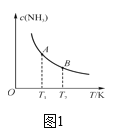
①已知H—H键键能为436kJ·mol-1,N≡N键键能为945 kJ·mol-1,N—H键键能为391 kJ·mol-1。由键能计算消耗1 mol N2时的ΔH=_____。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡____(填“向左”、“向右”或“不”)移动。
②如图中,当温度由T1变化到T2时,KA___(填“>”、“<”或“=”)KB。
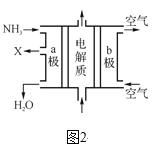
③废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作____(填“正”、“负”、“阴”或“阳”)极,其电极反应式为____。
(2)某温度下在容积固定的密闭容器中,下列反应达到平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始n(CO)∶n(H2O) | CO转化率 | H2O转化率 |
1∶1 | 0.5 | 0.5 |
1∶2 | 0.67 | 0.33 |
1∶3 | 0.75 | 0.25 |
①该反应的平衡常数为_____。该温度下,向容器中充入1 mol CO、3 mol H2O、2 mol CO2、1.5 mol H2,则起始时该反应速率v(正)______(填“>”、“<”或“=”)v(逆)。
②结合表中数据,判断下列说法正确的是_______(填字母)。
A.增加H2O(g)的量,CO的转化率升高而H2O(g)的转化率降低
B.若CO与H2O(g)的转化率相同,二者的初始投入量一定相同
C.CO和H2O(g)初始物质的量之比等于二者转化率之比
D.当CO与H2O(g)物质的量之比为1∶4时,CO的转化率为0.85
③该温度下,向容器中充入2 mol CO、2 mol H2O,达平衡时放出a kJ热量,则该反应的ΔH=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题:
(1)现有下列9种物质:①氯气;②二氧化硫;③氢氧化铁胶体;④铁;⑤氯化钡;⑥氢氧化钾;⑦氯化铁溶液;⑧酒精(C2H5OH);⑨氧化钙。
用相应化学式填写下列空白:属于酸性氧化物的有____,属于电解质的是______,属于非电解质的_______。(用相应化学式填空)
下列关于③和⑦的说法正确的是____(填字母序号)。
a.都不稳定,密封静置会产生沉淀 b.③能产生丁达尔效应,而⑦不能
c.分散质粒子都可以通过滤纸 d.加入盐酸都会先产生沉淀,后溶解
(2)标准状况下,2.24 L Cl2的质量为__________;有__________个氯原子。
(3)10.8g R2O5中氧原子的数目为3.01×1023, 则元素R的相对原子质量为________;R元素名称是_______。
(4)如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(设NA为阿伏加德罗常数)______________。
(5)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。则该混合气体中CH4和O2的体积比为_______。
(6)物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为5∶3∶2时,三种溶液中c(Cl)之比为____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稠环芳烃如萘![]() 、菲
、菲 、芘
、芘 等均为重要的有机化工原料。下列说法正确的是
等均为重要的有机化工原料。下列说法正确的是
A. 萘、菲、芘互为同系物B. 萘、菲、芘的一氯代物分别为2、5、3种
C. 萘、菲、芘中只有萘能溶于水D. 萘、菲、芘的所有原子不可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于加成反应的是( )
A. 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
B. CH2===CH2+HBr―→CH3CH2Br
C. CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
D. CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表一部分,列出了九种元素在周期表中的位置:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
请用化学用语回答下列问题
(1)在上述元素中,金属性最强的是____________。
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是________(填物质化学式)。写出⑥和⑧的最高价氧化物对应的水化物反应的离子方程式 _______________________________。
(3)只由④形成的18电子微粒的电子式 _______________。
(4)写出由①和③形成的离子化合物的化学式 ____________________________。
(5)用电子式表示⑦和⑨形成的化合物的形成过程_________________________________。
(6)表中元素③和⑤可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式 _________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com