
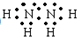 ,过氧化氢的结构式:
,过氧化氢的结构式: .
.分析 (1)肼分子式为NH2-NH2,每个氮原子形成三个化学键,过氧化氢分子式H2O2,每个氧原子形成两个共价键,据此书写;
(2)依据热化学方程式书写方法写出,标注物质聚集状态和反应焓变;
(3)依据热化学方程式和盖斯定律计算得到热化学方程式,得到反应的焓变;
(4)肼燃烧生成氮气和水;
解答 解:(1)肼分子式为NH2-NH2,每个氮原子形成三个化学键,电子式为: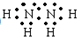 ;过氧化氢分子式H2O2,每个氧原子形成两个共价键,分子结构为:
;过氧化氢分子式H2O2,每个氧原子形成两个共价键,分子结构为: ;
;
故答案为: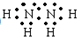 ;
; ;
;
(2)0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量,32g肼燃烧放热641.625kJ;肼燃烧的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol;
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol;
(3)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol,
②H2O(l)═H2O(g)△H=+44kJ/mol;
依据盖斯定律,①-②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.625kJ/mol
则16g液态肼与足量液态过氧化氢反应生成氮气和液态水放热时408.8KJ;
故答案为:408.8KJ;
(4)肼燃烧生成氮气和水,除释放大量热和快速产生大量气体外,生成的物质无污染;
故答案为:生成N2和H2O,对环境无污染.
点评 本题考查了化学反应能量变化的计算应用,物质结构分析判断,盖斯定律的计算,热化学方程式书写方法,题目难度中等.


科目:高中化学 来源: 题型:解答题
 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了能量最低、泡利原理和洪特规则.
,这样排布遵循了能量最低、泡利原理和洪特规则.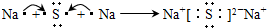 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下22.4 L NO与11.2 L O2混合后所得气体分子数为6.02×1023 | |
| B. | 标准状况下3.36 L CCl4含碳原子数为0.15×6.02×1023 | |
| C. | 1 mol甲基(-CH3)中所含电子数为9×6.02×1023 | |
| D. | 2 L 1 mol•L-1 的盐酸中所含氯化氢分子数为2×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入相同物质的量浓度的盐酸 | B. | 加入相同物质的量浓度的硝酸 | ||
| C. | 加入相同物质的量浓度的硫酸 | D. | 加入少量的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 操作 | |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液,看紫红色是否褪去 |
| C | 分离Br2和CCl4混合物 | 向混合物中加入蒸馏水,然后分液 |
| D | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
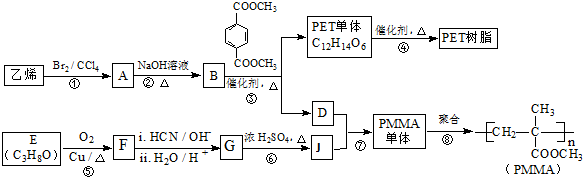 已知:
已知: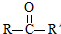 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$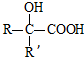 (R、R’代表烃基)
(R、R’代表烃基) .
. .
. .
.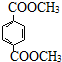 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH查看答案和解析>>
科目:高中化学 来源: 题型:解答题
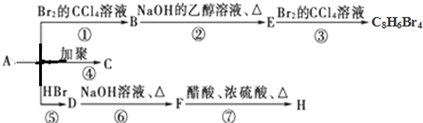
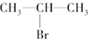 (主要产物)
(主要产物)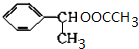 ,
,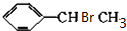 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$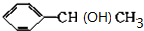 +NaBr.
+NaBr.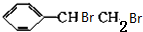 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$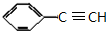 +2NaBr+2H2O
+2NaBr+2H2O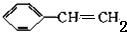 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$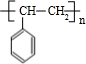 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com