
��һ����������ͨ��30 mLŨ��Ϊ10.00 mol/L����������Ũ��Һ�У���������ʱ�����Һ���γ�NaCl��NaClO��NaClO3������ϵ�������жϲ���ȷ����
A����NaOH��Ӧ������һ��Ϊ0.15 mol
B��n(Na��)��n(Cl��) ����Ϊ7��3
C������Ӧ��ת�Ƶĵ���Ϊn mol����nһ������0.15 mol
D��n(NaCl)��n(NaClO)��n(NaClO3)����Ϊ7��2��1
��֪ʶ�㡿������ԭ��Ӧ�������غ�Ӧ��
���𰸽�����B ��������A�����ڷ�Ӧ����ϵ��û��NaOH�����������Ʒ�Ӧ�꣬������Ԫ���غ�n��NaOH��=n��NaCl��+n��NaClO��+n��NaClO3��=0.03L��10mol/L=0.3mol��������ԭ���غ���2n��Cl2��=n��NaCl��+n��NaClO��+n��NaClO3��=0.3mol���ʲμӷ�Ӧ������n��Cl2��=0.15mol����A��ȷ��
B�����ݷ���ʽCl2+2NaOH=NaCl+NaClO+H2O��3Cl2+6NaOH=5NaCl+NaClO3+3H2O��֪������������ֻ��NaClO��n��Na+����n��Cl-�����Ϊ2��1������������ΪNaClO3��n��Na+����n��Cl-����СΪ6��5����6��5��n��Na+����n��Cl-����2��1��7��3��2��1����B����
C�����ݷ���ʽCl2+2NaOH=NaCl+NaClO+H2O��3Cl2+6NaOH=5NaCl+NaClO3+3H2O��֪����������ֻ��NaClO��ת�Ƶ��������٣�Ϊ0.3mol��1/2��1=0.15mol����������ֻ��NaClO3��ת�Ƶ�������࣬Ϊ0.3mol��5/6��1=0.25mol����C��ȷ��
D����n��NaCl��=7mol��n��NaClO��=2mol��n��NaClO3��=1mol������NaCl��õĵ���Ϊ7mol��1=7mol������NaClO��NaClO3ʧȥ�ĵ���Ϊ2mol��1+1mol��5=7mol����ʧ������ȣ���D��ȷ��
�ʴ�ѡB
��˼·�㲦�����⿼��������ԭ��Ӧ��֪ʶ������д�����ܷ����ķ�Ӧ������Ԫ���غ㡢�����غ㡢������ʹ����˳�������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Һ���ܴ������棬����ҺΪ��ɫ������������
A.K+��Cu2+��Na+��Cl- B. K+��NO3-��Na+��CO32-
C. H+��NO3-��Na+��HCO3- D.Ag+��Na+��Cl-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Fe2����I����Br������Һ��ͨ��������������
Һ�и������ӵ����ʵ����仯��ͼ��ʾ���й�˵������ȷ����( )
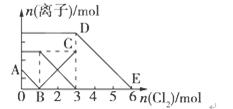
A���߶�BC����Fe3�����ʵ����ı仯���
B��ԭ�����Һ��n(FeBr2)=3mol
C����ͨ��2molCl2ʱ����Һ���ѷ��������ӷ�ӦΪ��2Fe2��+2I��+2Cl2=2Fe3��+I2+4Cl��
D��ԭ��Һ��n(Fe2��)��n(I��)��n(Br��)=3��1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�δ�������ҽѧ���δȵġ�ϴԩ��¼�����С������鶾���ļ��أ��������鶾����ԭ����4Ag+2H2S+O2===2 Ag2S +2H2O������H2S��
A�������� B����ԭ��
C���������������ǻ�ԭ�� D���Ȳ����������ֲ��ǻ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Fe2����I����Br������Һ��ͨ��������������Һ�и������ӵ����ʵ����仯��ͼ��ʾ���й�˵������ȷ����( )

A���߶�BC����Fe3�����ʵ����ı仯���
B��ԭ�����Һ��n(FeBr2)=3mol
C����ͨ��2molCl2ʱ����Һ���ѷ��������ӷ�ӦΪ��2Fe2��+2I��+2Cl2=2Fe3��+I2+4Cl��
D��ԭ��Һ��n(Fe2��)��n(I��)��n(Br��)=3��1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ������������������ء�����������ȷ����
A�������������ˮ����ȡ�塢ʯ�͵ķ���ú�ĸ�����������仯
B��BaSO4������ˮ��������ʣ���ҽѧ����������
C��14C��������������ļ�����14C��12C��Ϊͬλ��
D������������������ˮ��������ɱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ���ǣ� ��
A��Ũ��������ˮ�Ĺ������ڷ��ȷ�Ӧ
B�����л�ѧ���������л�ѧ�����ɵĹ���һ�����ڻ�ѧ��Ӧ
C�����ʵ���Ĺ���һ���������仯
D��ͬ���칹��֮����ת��һ���ǻ�ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ֻ��һ���Լ��Ϳɽ�AgNO3��KSCN��ϡH2SO4��NaOH������ɫ��Һ���ֿ����������Լ���(����)
A��BaCl2��Һ B��FeCl2��Һ
C��FeCl3��Һ D��Fe(NO3)3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʾ�������(�¶ȡ�ѹǿ)�ı仯�����з�Ӧ��Ӱ�죺L(s)��G(g)
 2R(g)����H<0����ͼ�У�Y����ָ(����)
2R(g)����H<0����ͼ�У�Y����ָ(����)
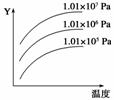
A��ƽ����������G����������
B��ƽ����������R����������
C��G��ת����
D��L��ת����
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com