
| A. | Na+、K+、CO32-、NO3- | B. | Mg2+、NH4+、SO42-、Cl- | ||
| C. | Fe3+、K+、NO3-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
分析 碱性溶液中存在大量氢氧根离子,无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.四种离子之间不反应,都不与氢氧根离子反应;
B.镁离子、铵根离子与氢氧根离子反应;
C.铁离子为有色离子,铁离子与氢氧根离子反应;
D.碳酸氢根离子、钡离子与氢氧根离子反应生成碳酸钡沉淀.
解答 解:碱性溶液中存在大量氢氧根离子,无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.Na+、K+、CO32-、NO3-之间不反应,都不与氢氧根离子反应,且为无色溶液,在溶液中能够大量共存,故A正确;
B.Mg2+、NH4+与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.Fe3+为有色离子,Fe3+与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.Ba2+、HCO3-与氢氧根离子反应生成难溶物碳酸钡,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.


科目:高中化学 来源: 题型:选择题
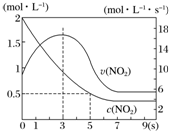 某绝热恒容容器中充入2mol•L-1 NO2,发生反应2NO2(g)═N2O4(g)△H=-56.9kJ•mol-1.下列分析不正确的是( )
某绝热恒容容器中充入2mol•L-1 NO2,发生反应2NO2(g)═N2O4(g)△H=-56.9kJ•mol-1.下列分析不正确的是( )| A. | 5s时NO2的转化率为75% | |
| B. | 0~3 s时v(NO2)增大是由于体系温度升高 | |
| C. | 3s时化学反应处于平衡状态 | |
| D. | 9s时再充入N2O4,平衡后K较第一次平衡时大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ/mol | 348 | 413 | 436 | 358 | x | 463 |
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol/L | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该氯原子的相对原子质量为$\frac{a}{b}$ | |
| B. | m g该氯原子的物质的量为$\frac{m}{a{N}_{A}}$mol | |
| C. | 该氯原子的摩尔质量为aNAg | |
| D. | a g该氯原子所含的电子数为17 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH | B. | CH3COOH | C. | C2H5OH | D. | C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,92 g NO2和N2O4混合气体含有的原子数为6 NA | |
| B. | 5.6 g金属铁与足量稀盐酸反应,失去的电子数为0.3 NA | |
| C. | 标准状况下,ll.2 LSO3含有的分子数为0.5 NA | |
| D. | 25℃、101 kPa时,64 g SO2中含有的氧原子数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com