
下列实验装置或操作正确的是

A.图①向Ⅰ中通入过量CO2,出现白色沉淀,则溶液中一定含有AlO2-
B.图②两支试管中的蛋白质济液均会变性
C.图③装置用来除去C2H4中的杂质SO2
D.图④装置用来灼烧海带成灰
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:2016届宁夏银川市高三4月质检理综化学试卷(解析版) 题型:实验题
黄铜矿(主要成分为CuFeS2 ,S为-2价)是工业炼铜的主要原料,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,设计了如下实验:

现称取研细的黄铜矿样品1.84g,在空气存在下进行煅烧,发生如下反应:
实验后取d中溶液的 置于锥形瓶中,用0.0500mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
置于锥形瓶中,用0.0500mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
(1)中氧化产物是 ,当生成0.3molSO2气体时,转移电子 mol。
(2)将样品研细后再反应,其目的是 ;装置c的作用是 。
(3)用标准碘溶液滴定d中溶液的离子方程式是 ,滴定达终点时的现象是 。
(4)上述反应结束后,仍需通一段时间的空气,其目的是 。
(5)通过计算可知,该黄铜矿的纯度为 。
(6)若将原装置d中的试液换为Ba(OH)2溶液,测得黄铜矿纯度偏高,假设实验操作均正确,可能的原因主要是 。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三下学期考前练习化学试卷(解析版) 题型:实验题
ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得,无水草酸100℃可以升华,某学习小组用下图装置模拟工业制取收集ClO2。

(1)实验时装置A需在60℃~100℃进行的原因是______________,控制所需温度的方法是__________;
(2)电动搅拌棒的作用是______________,装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为_________________;
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2,写出反应的离子方程式_________________;
(4)用ClO2处理过的饮用水(pH为5.5~6.5)往往残留少量ClO2和一定量对人体不利的亚氯酸根离子(ClO2-).
①ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图2所示
②当pH≤2.0时,ClO2-也能被I-还原成Cl-
③2Na2S2O3+I2=Na2S4O6+2NaI
根据上述信息,请补充完整测定饮用水中ClO2-含量的实验方案:
取一定体积的饮用水,加入NaOH溶液调节pH为7.0~8.0;______________________________________
_________________________________________________________________________________;再重复上述操作1~2次,计算得出结果。
(实验中需使用的试剂:淀粉溶液、标准Na2S2O3溶液、KI溶液、稀硫酸)
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三下学期考前练习化学试卷(解析版) 题型:选择题
下列有关化学用语正确的是
A.中子数为18的硫原子:3416S
B.氨分子的电子式: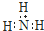
C.苯乙酸钠的结构简式: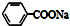
D.H2SO3的电离方程式:H2SO3?2H++SO32
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三三模理综化学试卷(解析版) 题型:填空题
能源和环境保护是世界各国关注的热点话题。请回答下列问题:
Ⅰ.目前“低碳经济”正成为科学家研究的主要课题。甲烷自热重整是一种先进的制氢方法,其反应方程式为CH4(g) +H2O (g) =CO (g) +3H2(g) 。
阅读下图,计算该反应的反应热△H=____________kJ·mol-1。
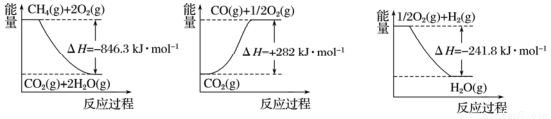
Ⅱ.收集和利用CO2是环境保护的热点课题。
500℃时,在容积为1L的密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:C02(g) +3H2 (g) =CH3OH (g) +H2O (g) △H<0,测得CO2和CH3OH的浓度与时间的关系如图所示。
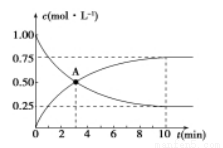
(1) 0~10 min内v(H2)=_____________, A点含义是_____________。该反应平衡常数表达式K=____________。
(2)反应在500℃达到平衡后,改变反应温度为T, CH3OH的浓度以每分钟0. 030 mol/L逐渐增大,经5 min又达到新平衡。T______(填“>”、“<”或“=”)500℃,判断理由是_____________。
(3)温度为T时,反应达到平衡后,将反应容器的容积增大一倍。平衡向____________(填“正”或“逆”)反应方向移动,判断理由是____________。
Ⅲ.电化学法处理SO2是目前研究的热点。
利用双氧水吸收SO2可消除SO2污染,设计装置如图所示。
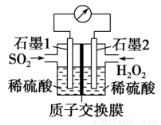
(1)石墨1为___________(填“正极”或“负极”);正极的电极反应式为____________。
(2)若11.2 L(标准状况)SO2参与反应,则迁移H+的物质的量为____________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:填空题
火力发电厂释放出大量氮氧化合物(NOx)、SO2和 CO2等气体会造成环境问题对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为____________________。
(2)脱碳。将 CO2转化为甲醇:CO2 (g)+3H2 (g)  CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①如图 1,25℃时以甲醇燃料电池(电解质溶液为 KOH)为电源来电解乙(100mL2mol/LAgNO3溶液)和丙(100mLCuSO4)溶液,燃料电池负极的电极反应为_______________。电解结束后,向丙中加入 0.1mol Cu(OH)2,恰好恢复到反应前的浓度,将乙中溶液加水稀释至200mL,溶液的 pH ______________;

②取五份等体积的 CO2和H2的混合气体(物质的量之比均为 1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数 φ (CH3OH)与反应温度 T 的关系曲线如图 2 所示,则上述 CO2转化为甲醇的反应的△H________3.0 (填“>”、“<”或“=”)。
(3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应生成硫酸铵。室温时,向(NH4)2SO4,溶液中滴人 NaOH 溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)________ c(NH3 •H2O)。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:选择题
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO - 将CN- 氧化为两种无污染的气体,下列说法正确的是
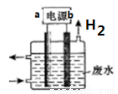
A.阴极的电极反应式为:Cl - +2OH - -2e- =ClO - +H 2O
B.阳极的电极反应式为:2CN- +12OH - -10e - =N2↑+2CO 3 2- +6H 2 O
C.电解时使用锂钒氧化物二次电池(V2O5 +xLi LixV2O5)做电源,电池充电时a 电极的电极反应式为:LixV2O5 _ xe-=V2O5 + xLi +
LixV2O5)做电源,电池充电时a 电极的电极反应式为:LixV2O5 _ xe-=V2O5 + xLi +
D.除去CN-的反应:2CN- +5ClO- +2H+ =N2↑+2CO2↑+5Cl- +H2O
查看答案和解析>>
科目:高中化学 来源:2016届宁夏石嘴山三中高三下四模理综化学试卷(解析版) 题型:实验题
【化学—选修5有机化学基础】
姜黄素具有抗突变和预防肿瘤的作用,其合成路线如下:

已知:
i.1 mol G最多能消耗Na、NaOH、NaHCO3的物质的量分别为3 mol、2 mol、1 mol。
ii.
iii. (R1、R2、R3为烃基或氢原子) 请回答:
(R1、R2、R3为烃基或氢原子) 请回答:
(1)B→C的反应类型是 。
(2)C→D反应的化学方程式是 。
(3)E的核磁共振氢谱中有两个峰,E中含有的官能团名称是 。
E→G反应的化学方程式是 。
(4)下列有关香兰醛的叙述不正确的是 。
a.香兰醛能与NaHCO3溶液反应
b.香兰醛能与浓溴水发生取代反应
c.1 mol香兰醛最多能与3 molH2发生加成反应
(5)写出一种符合下列条件的香兰醛的同分异构体的结构简式 。
①苯环上的一硝基取代物有2种
②1 mol该物质水解,最多消耗3 molNaOH
(6)姜黄素的分子中有2个甲基,其结构简式是 。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下学期冲刺模拟理综化学A卷(解析版) 题型:实验题
[化学—选修2:化学与技术] 工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为: ;
②硫酸钠和焦炭、石灰石反应的化学方程式为: (已知硫酸钠做氧化剂,生成物中气体只有一种)。
(2)氨碱法的工艺如图所示,得到的碳酸氢钠经煅烧生成纯碱。
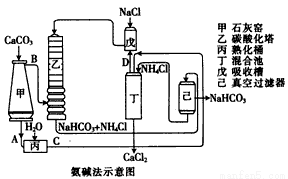
①图中的中间产物C是_______,(填化学式,下同)D是_______;
②装置乙中发生反应的化学方程式为 。
(3)联合制碱法是对氨碱法的改进,其优点是除了副产物氯化铵可用作化肥外还有______________。
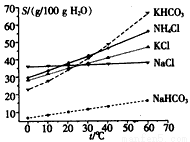
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com