
【题目】铜、硼、硅、砷等元素的化合物是制造新型激光武器和新型太阳能电池的重要材料。回答下列问题:

(1)基态硅原子电子占据的最高能层符号是_____,其中能量最高的电子所占据能级的原子轨道有_____个伸展方向,原子轨道呈_____形。
(2)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有____________。
(3)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的第一电离能从大到小的顺序为________(用元素符号表示)。H2SeO3的酸性_______H2SeO4(填“强于”或“弱于”),原因是___________(从分子结构的角度回答)。
(4)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。它的晶体结构如右图所示。六方相氮化硼______π键(填“含有”或“不含”),其质地软的原因是_________。NaBH4是一种重要的储氢载体,阴离子的的立体结构_________。
【答案】M 3 哑铃 离子键、配位键 Br>As>Se 弱于 H2SeO4中非羟基氧原子数目越多,中心硒原子价态越多,导致Se-O-H中的氧原子更向Se偏移,更容易电离出H+,酸性越强 不含 层间作用力小,质地软 正四面体
【解析】
(1)基态硅原子核外共有三个电子层,越往外层能量最高,能量最高的电子是3p轨道上的电子。
(2)[Cu(NH3)4]SO4晶体中含有的化学键除普通共价键外,还有阴、阳离子间的离子键,中心离子与配体间的配位键。
(3)砷的4P轨道上半充满电子,第一电离能出现反常。H2SeO3为弱酸,H2SeO4为强酸,原因可从中心原子与氧原子间的共用电子对分析。
(4)六方相氮化硼中,B的最外层只有3个电子,全部用于形成共价键;层与层之间只有范德华力,所以质地软。NaBH4是一种重要的储氢载体,阴离子BH4-满足AB4型结构。
(1)基态硅原子核外电子占据的最高能层,是原子核外的第三层,符号是M,其中能量最高的电子所占据能级的原子轨道为P轨道,有3个伸展方向,原子轨道呈哑铃形。答案为:M;3;哑铃;
(2)[Cu(NH3)4]SO4晶体中含有的化学键除普通共价键外,还有阴、阳离子间的离子键,中心离子与配体间的配位键。答案为:离子键、配位键;
(3)砷的4P轨道上半充满电子,第一电离能出现反常,则三种元素的第一电离能从大到小的顺序为Br>As>Se。H2SeO3的酸性弱于H2SeO4,原因是H2SeO4中非羟基氧原子数目越多,中心硒原子价态越多,导致Se-O-H中的氧原子更向Se偏移,更容易电离出H+,酸性越强。答案为:Br>As>Se;弱于;H2SeO4中非羟基氧原子数目越多,中心硒原子价态越多,导致Se-O-H中的氧原子更向Se偏移,更容易电离出H+,酸性越强;
(4)六方相氮化硼中,B的最外层只有3个电子,全部用于形成共价键,所以六方相氮化硼不含π键;层与层之间只有范德华力,所以质地软。NaBH4是一种重要的储氢载体,阴离子BH4-满足AB4型结构,阴离子的的立体结构为正四面体。答案为:不含;层间作用力小,质地软;正四面体。


科目:高中化学 来源: 题型:
【题目】 按要求对下图中两极进行必要的连接并填空:
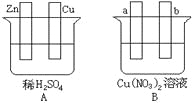
(1)在A图中请加以必要连接,使锌片不断损耗,铜片上冒H2气泡。则连接后的装置叫_______。
电极反应式:锌板:_______;铜板:_______。
(2)在B图中a、b均是惰性电极,加以必要的连接后,使a极析出铜, b极放出气体。该装置叫_______。
电极反应式:a极_______b极:_______。
经过一段时间后,停止反应并搅匀溶液,溶液的pH值_______(填 “升高、降低或不变”),加入一定量的_______后,溶液能恢复至与电解前完全一致。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.肼(N2H4)又称联氨,常温时是一种可燃性液体,可用作火箭燃料。
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4
上述反应热效应之间的关系式为ΔH4=___。(用ΔH1、ΔH2、ΔH3表示)
II.如图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。
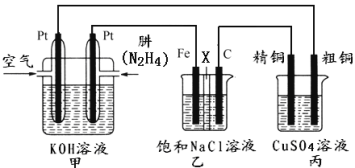
根据要求回答相关问题:
(1)甲装置中通入___气体的一极为正极。
(2)乙装置中石墨电极为___极,其电极反应式为__;可以用__检验该反应产物,电解一段时间后,乙池中的溶液呈__性。
(3)图中用丙装置模拟工业中的___原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝和钙是中学化学常见的三种重要金属。请回答下列问题:
(1)常盛放在呼吸面具中作为供氧剂的物质为____________(填“![]() ”或“
”或“![]() ”)。
”)。
(2)![]() 能溶于酸或强碱溶液生成盐和水,则
能溶于酸或强碱溶液生成盐和水,则![]() 是一种____________(填“酸性”“碱性”或“两性”)氧化物。
是一种____________(填“酸性”“碱性”或“两性”)氧化物。
(3)漂白粉的有效成分为____________(填“![]() ”或“
”或“![]() ”)。
”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)工业上常用铝土矿冶炼金属铝。
①铝土矿的主要成分为![]() 和
和![]() ,其中
,其中![]() 属于____________(填“酸性”“碱性”或“两性”)氧化物;
属于____________(填“酸性”“碱性”或“两性”)氧化物;
②冶炼过程中需要用到氨,氨溶于水所得溶液呈____________(填“酸性”或“碱性”);
③利用金属活动性的不同,可以采用不同的冶炼方法,制取单质铝应采取_____________(填“热还原法”或“电解法”)。
(2)工业上合成氨的反应为:![]() ,一定条件下,将
,一定条件下,将![]() 和
和![]() 置于
置于![]() 的密闭容器中,
的密闭容器中,![]() 后测得
后测得![]() 为
为![]() 。
。
①用![]() 表示该反应的速率为___________;
表示该反应的速率为___________;
②其他条件不变时,再通入![]() ,该反应的速率将_____________(填“增大”或“减小”)。
,该反应的速率将_____________(填“增大”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2NaHCO3![]() Na2CO3 + H2O+CO2 ,现把14.8g Na2CO310H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2molL﹣1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
Na2CO3 + H2O+CO2 ,现把14.8g Na2CO310H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2molL﹣1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
A. 6.36gB. 3.18gC. 4.22gD. 5.28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把河沙(主要成分是![]() )与镁粉按一定质量比(质量比略大于
)与镁粉按一定质量比(质量比略大于![]() )混合均匀,装入试管中加热大约
)混合均匀,装入试管中加热大约![]() 后发生剧烈反应,生成一种白色固体化合物和一种硅化物,待生成的混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
后发生剧烈反应,生成一种白色固体化合物和一种硅化物,待生成的混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
(1)写出河沙与镁粉在加热条件下发生反应的化学方程式:______。
(2)生成的混合物放入稀硫酸中,产生的气体是______(填分子式)。
(3)用化学方程式表示产生“爆炸声”的原因:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
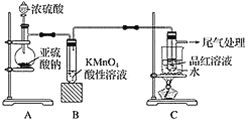
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为_______。
(2)实验过程中,装置B中产生的现象为_______,这说明SO2具有____。
(3)装置C的目的是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象:_________。
(4)尾气可采用________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.电离平衡常数是衡量弱电解质电离程度的量,已知如表数据(25℃):
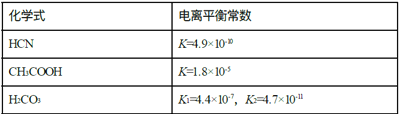
(1)25℃时,下列物质的量浓度相同的四种溶液的pH由大到小的顺序为_____(填序号)
a NaCN溶液 b Na2CO3溶液 c CH3COONa溶液 d NaHCO3溶液
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为____________。
Ⅱ.根据下列化合物:①NaOH ②H2SO4 ③CH3COOH ④NaCl ⑤CH3COONa ⑥(NH4)2SO4 ⑦CH3COONH4 ⑧NH4HSO4 ⑨NH3H2O ⑩NH4Cl,请回答下列问题:
(1)常温下,若pH均为11且等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m_______n(填“<”、“>”或“=”)。
(2)已知水存在如下平衡:H2O![]() H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是____________。
H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是____________。
A 向水中加入NaHSO4固体 B 向水中加NaHCO3固体
C 加热至100℃[其中c(H+)=1×10-6 mol·L-1] D 向水中加入NH4Cl固体
(3)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液中,水电离的OH-浓度由大到小的顺序为(填序号)__________。
(4)物质的量浓度相同的⑥、⑦、⑧、⑨、⑩五种稀溶液中,NH4+浓度由大到小的顺序是(填序号)______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com