
把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是
A.自来水 B.0.5 mol·L-1盐酸
C.0.5 mol·L-1 CH3COOH溶液 D.0.5 mol·L-1 KCl溶液
科目:高中化学 来源:2015届河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列分子式表示的物质一定是纯净物的是
A.C3H6 B.C4H10 C.CH2Cl2 D.C2H4O
查看答案和解析>>
科目:高中化学 来源:2015届江西省赣州市六校高二上学期期末联考化学试卷(解析版) 题型:选择题
把Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡: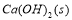

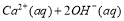 ,下列说法正确的是( )
,下列说法正确的是( )
A.恒温下向溶液中加CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高二上学期期末考试化学试卷(解析版) 题型:选择题
pH=a某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH<a,则该电解质可能是
A.Ba(OH)2 B.HCl C.Na2SO4 D.AgNO3
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高二上学期期末考试化学试卷(解析版) 题型:选择题
在密闭容器中充入4 mol SO2和3 mol O2,一定条件下建立如下平衡:2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ/mol,测得SO2的转化率为90%,则在此条件下反应放出的热量为
2SO3(g) ΔH=-Q kJ/mol,测得SO2的转化率为90%,则在此条件下反应放出的热量为
A.2Q kJ B.Q kJ C.1.8Q kJ D.0.9Q kJ
查看答案和解析>>
科目:高中化学 来源:2015届江苏省教学协作体高二上学期期末化学试卷(解析版) 题型:填空题
⑴良好的生态环境可以提升生活质量。
①2013年10月,全国多个省市出现严重的雾霾天气。导致雾霾形成的主要污染物是_____(填字母)。 A.SO2 B.NO2 C.PM2.5
②选择环保的装修材料可以有效地减少居室污染。劣质胶合板释放的主要污染物是_______(填字母)。 A.NO B.CO C.甲醛
③使用漂白粉对水进行杀菌消毒,其作用原理可用化学方程式表示为 。
⑵均衡的膳食结构可以保障身体健康。
①碘是人体必需的微量元素。合理食用加碘盐是防止缺碘性疾病的有效方法之一。人体如果缺碘可能会导致或引起的疾病是 (答一种即可)。
②纤维素被称为“第七营养素”,从化学成分看,纤维素属于 (填“糖类”、“蛋白质”或“油脂”)。
③新鲜水果中的VC具有___(填“氧化”或“还原”)性质。阿司匹林具有___作用。
⑶汽车尾气(含有烃类、CO、SO2与NO等物质)是城市的污染源之一。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成无毒气体,并促使烃类充分燃烧及SO2的转化。
①写出CO与NO反应的化学方程式: 。
②控制城市空气污染源的方法可以有: (多选)
A.开发新能源 B.使用电动车 C.植树造林 D.戴上呼吸面具
查看答案和解析>>
科目:高中化学 来源:2015届江苏省教学协作体高二上学期期末化学试卷(解析版) 题型:选择题
除去下列物质中的杂质(括号内是杂质),能采用加入过量NaOH溶液充分反应再过滤的方法的是
A.FeCl2溶液(FeCl3) B.KNO3(NaCl)
C.NaCl(CaCO3) D.CuO(Al2O3)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省扬州市高二下学期学业水平模拟化学试卷(二)(解析版) 题型:填空题
利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:①5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 。
(2)滤液经处理可得到副产品 。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为 。(写出计算过程)
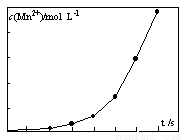
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应 液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省扬州市高二上学期期末考试化学试卷(选修)(解析版) 题型:选择题
除去下列物质中的杂质(括号内的物质),所使用的试剂和主要操作都正确的是
选项物质使用的试剂主要操作
A乙醇(水)金属钠蒸馏
B乙酸乙酯(乙酸)饱和碳酸钠溶液分液
C苯(苯酚)浓溴水过滤
D乙烷(乙烯)酸性高锰酸钾溶液洗气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com