
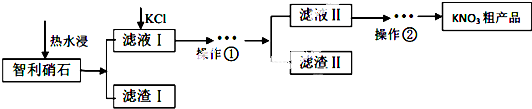
 | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 100 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 110.0 | 169 | 246 |
| KCl | 27.7 | 31 | 34.0 | 37.0 | 40.0 | 45.5 | 51.1 | 56.7 |
| NaNO3 | 73 | 80 | 88 | 96 | 104 | 124 | 148 | 180 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.3 | 38.4 | 39.8 |


科目:高中化学 来源: 题型:
| A、CH3CH2OH、SO3和水分别属于非电解质、强电解质和弱电解质 |
| B、为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
| C、煤油可由石油分馏获得,可用于保存少量金属钠 |
| D、工业上金属Mg、Al都是用电解其相应的氯化物水溶液制得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
(1)用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:| 化学键 | H-H | N-H | N≡N |
| 键能kJ?mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:
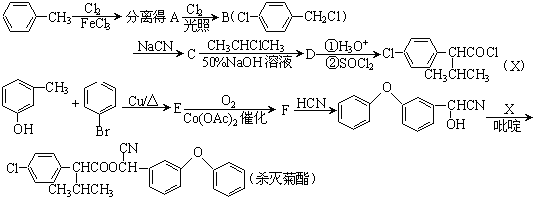
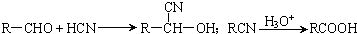 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
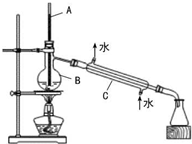 现有一瓶乙二醇和丙三醇的混合物,它们有如下性质,使用右图装置进行分离,下列说法正确的是( )
现有一瓶乙二醇和丙三醇的混合物,它们有如下性质,使用右图装置进行分离,下列说法正确的是( )| 物质 | 沸点/℃ | 溶解性 |
| 乙二醇 | 198 | 易溶于水和乙醇 |
| 丙三醇 | 290 | 能跟水、乙醇任意比互溶 |
| A、在正确操作情况下,锥形瓶中收集到的物质为乙二醇 |
| B、仪器C中进出水口方向错误 |
| C、仪器A为玻璃棒,所处位置错误 |
| D、仪器B的名称为圆底烧瓶. |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图Ⅰ为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图Ⅰ为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
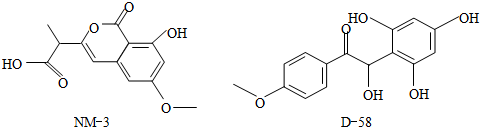
| A、都能与NaOH溶液反应,且等量时消耗的NaOH相同 |
| B、都不能与NaHCO3溶液反应产生CO2 |
| C、都不能发生消去反应,原因完全相同 |
| D、都能与溴水反应,原因完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为防止富脂食品氧化变质可以在包装袋中加入生石灰 |
| B、用医用酒精消毒是因为酒精可以使蛋白质发生盐析 |
| C、绿色食品是不含任何化学物质的食品 |
| D、钠可把钛、锆、铌、钽等金属从它们的熔融的卤化物里还原出来 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com