
| ||
| ||
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、2A13++3SO42-+3Ba2++6OH-→2A1(OH)3↓+3BaSO4↓ |
| B、A13++2SO42-+2Ba2++3OH-→A1(OH)3↓+2BaSO4↓ |
| C、A13++SO42-+Ba2++4OH-→A1O2-+BaSO4↓+2H2O |
| D、A13++2SO42-+2Ba2++4OH-→A1O2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
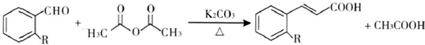
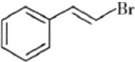 )具有强烈的类似素馨花青甜膏香,主要用于柏木,风信子,紫丁香,水仙,葵花香型皂用和洗衣粉香精中.以下是某课题组开发的从廉价、易得的化工原料出发制备E-β-溴代苏合香烯的合成路线:
)具有强烈的类似素馨花青甜膏香,主要用于柏木,风信子,紫丁香,水仙,葵花香型皂用和洗衣粉香精中.以下是某课题组开发的从廉价、易得的化工原料出发制备E-β-溴代苏合香烯的合成路线: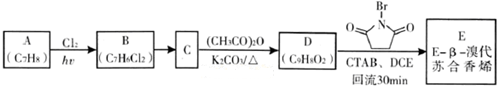
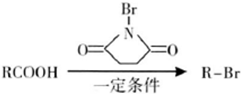
查看答案和解析>>
科目:高中化学 来源: 题型:
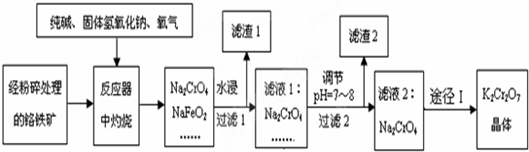
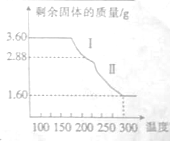 铁及铁的化合物用途非常广泛.
铁及铁的化合物用途非常广泛.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:2:3 |
| B、1:1:3 |
| C、1:1:1 |
| D、3:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
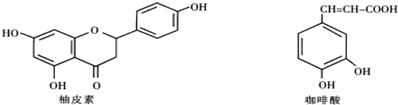
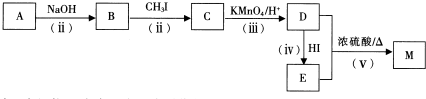

查看答案和解析>>
科目:高中化学 来源: 题型:
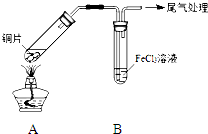 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.| 步骤① | 配制1mol?L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
| 步骤② | 往5mL 1mol?L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol?L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:
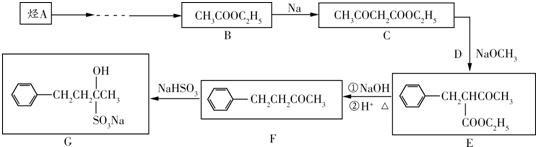
| 酸或酶 |
| 酒化酶 |
| ①NaOH |
| ②H+△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅晶体是一种无色透明的固体,常用作光导纤维的材料 |
| B、臭氧是一种有特殊臭味、氧化性极强的淡蓝色气体,可用作餐具的消毒剂 |
| C、铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝比铁更耐酸、碱的腐蚀 |
| D、人造纤维可利用竹子、棉花、麻类的纤维材料制成,而合成纤维是利用自然界的非纤维材料(如石油、煤)通过化学合成方法得到 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com