
【题目】某反应的微观示意图如图所示,下列说法错误的是
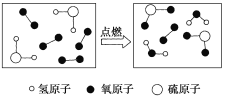
A.反应物中有单质
B.生成物均是氧化物
C.反应前是混合物,反应后是纯净物
D.化学方程式是2H2S+3O2![]() 2SO2+2H2O
2SO2+2H2O
科目:高中化学 来源: 题型:
【题目】古代有火烧孔雀石炼铜(加入炭)和湿法炼铜(在溶液中加铁),下列有关说法不正确的是( )
A. 火烧孔雀石炼铜发生的反应有Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
B. 火烧孔雀石炼铜发生的反应有2CuO+C![]() CO2↑+2Cu
CO2↑+2Cu
C. 湿法炼铜发生的主要反应为Fe+Cu2+===Cu+Fe2+
D. 两种炼铜的方法涉及的主要反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.6mol KCl、0.4mol Cu(NO3)2、0.2molAgNO3一起溶于水,配成100mL混合溶液,用惰性电极电解一段时间后,若在一极析出19.2g Cu,此时在另一极上产生气体的体积(标准状况下)为
A.3.96LB.4.48LC.5.6LD.6.72L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在人类的生产和生活中有着广泛的应用,某化学兴趣小组利用图一装置探究氨气的有关性质。
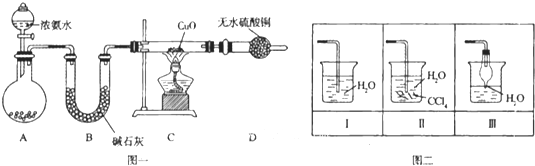
(1)装置A中烧瓶内试剂可选用 (填序号)。B的作用是
a.碱石灰 b.浓硫酸 c.生石灰 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先 (填I或Ⅱ).
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水 Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为 ,.该反应证明氨气具有 性.
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是 (填装置序号).
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,所得溶液的物质的量浓度为 mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( )
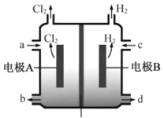
离子交换膜
A.电极A为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.饱和NaCl从a处进,NaOH溶液从d处出
D.OH-迁移的数量等于导线上通过电子的数量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种抗血栓药物,其合成路线流程图如下:
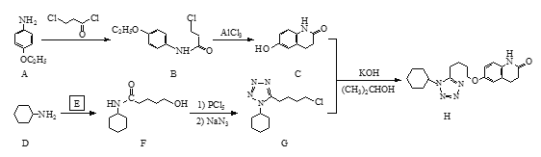
(1)B中的含氧官能团名称为_________________(写两种)。
(2)C + G → H 的反应类型为________________。
(3)环状分子E 的分子式为C5H8O2 ,写出E的结构简式:______________________。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式____________________。
①含有苯环和一种含氧官能团,能与FeCl3溶液发生显色反应;
②分子中有叁键,有一个手性碳原子,有5种不同化学环境的氢。
(5)已知: ![]() ;
;![]() 。
。
写出以![]() 和
和![]() 为原料制备
为原料制备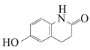 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。__________________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向![]() 盐酸中滴加
盐酸中滴加![]() 溶液,溶液的pH随
溶液,溶液的pH随![]() 溶液体积的变化如图。已知
溶液体积的变化如图。已知![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
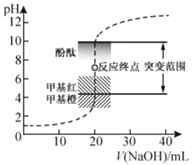
A.![]() 与盐酸恰好完全反应时,
与盐酸恰好完全反应时,![]()
B.选择变色范围在pH突变范围内的指示剂,可减小实验误差
C.选择甲基红指示反应终点,误差比甲基橙的大
D.![]() 时,
时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大________min(填“0~1”,“1~2”,“2~3”,“3~4”或“4~5”),原因是_____。
②求3~4 min时间段以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是________(填字母)。
A.蒸馏水 B.KCl溶液
C. KNO3溶液D.Na2SO4溶液
(3)某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
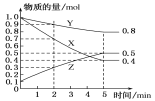
①该反应的化学方程式是_________。
②该反应达到平衡状态的标志是____(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1 mol Y的同时消耗2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定![]() 样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用
样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用![]() 标准溶液滴定至终点。重复实验,数据如下:
标准溶液滴定至终点。重复实验,数据如下:
序号 | 滴定前读数/mL | 滴定终点读数/mL |
1 | 0.00 | 19.98 |
2 | 1.26 | 22.40 |
3 | 1.54 | 21.56 |
已知:![]()
假设杂质不参加反应。
该样品中![]() 的质量分数是________%(保留小数点后一位);
的质量分数是________%(保留小数点后一位);
写出简要计算过程:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com