
| A、标准状况下,22.4LH2O含有的原子总数为3NA |
| B、常温常压下,含有NA个氖原子的氖气体积约为22.4L |
| C、4g金属钙变成钙离子时失去的电子数目为0.1NA |
| D、2L0.5mol?L-1的氯化镁溶液中所含的离子总数为3NA |
| m |
| M |
| m |
| M |
| 4g |
| 40g/mol |


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
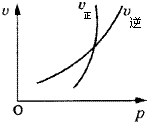
| A、N2O3(g)?NO2(g)+NO(g); 恒容时加入N2O3,平衡正向移动 |
| B、N2(g)+3H2(g)?2NH3(g); 将氨气液化分离后,有利于加快正反应速率 |
| C、4NH3(g)+5O2(g)?4NO(g)+6H2O(g); 加大氧气浓度,能提高氨气平衡转化率 |
| D、2SO2(g)+O2(g)?2SO3(g); 增大压强,平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA |
| B、80mL 10mol?L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA |
| C、含有4 NA个碳碳σ键的金刚石,其质量为24 g |
| D、含0.1 mol FeCl3的溶液完全水解后得到的胶体粒子个数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、任何化学反应都伴随有能量变化 |
| B、△H>0表示放热反应,△H<0表示吸热反应 |
| C、化学键的断裂会放出能量 |
| D、反应物总能量比生成物总能量高的反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加催化剂,V正、V逆都发生变化,且变化的倍数相等,平衡不移动 |
| B、加压,V正、V逆都增大,且V正增大的倍数大于V逆增大的倍数,平衡正移 |
| C、降温,V正、V逆都减小,且V逆减小的倍数小于V正减小的倍数,平衡逆移 |
| D、减少氨气的浓度,V正不变,V逆减小,且平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 异常情况 | 可能的原因 |
| ① | 蒸发结晶时,蒸发皿破裂 | 将溶液蒸干或酒精灯灯芯碰到蒸发皿底部 |
| ② | 分液时,分液漏斗中的液体很难滴下 | 没有打开分液漏斗颈上的玻璃塞或塞上的凹槽与漏斗上的小孔没有对齐 |
| ③ | 萃取时,振荡溶液,静置不分层 | 萃取剂加得太多 |
| ④ | 蒸馏时,发现冷凝管破裂 | 没有通冷凝水或先加热后通冷凝水 |
| A、① | B、② | C、③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和 c.实验①和 |
| ② | ||||
| ③ | ||||
| ④ |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| ① | 14.0 | 13.0 | 11.0 |
| ② | 6.0 | 7.0 | 7.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com