
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |

分析 (1)根据乙醛与氧气发生氧化反应生成乙酸;
(2)根据实验开始时温度计应测量反应溶液的温度,控制反应温度为60℃~80℃;根据蒸馏原理,温度计测量的是蒸气的温度;
(3)B中装的液体直接受热,可以让试管A内的反应液均匀受热发生反应,根据乙酸的沸点为117.9℃,还可以使生成的乙酸蒸气进入试管;若通过蒸馏的方法得到乙酸,B内盛装的液体的沸点应大于117.9℃;
(4)根据乙酸具有酸的通性来解答;
(5)根据强酸制弱酸,乙酸和碳酸钠反应生成二氧化碳,说明乙酸的酸性大于碳酸,乙酸易挥发,导致二氧化碳中含有乙酸,用饱和碳酸氢钠溶液除去乙酸,二氧化碳和苯酚钠溶液反应生成苯酚和碳酸氢钠,苯酚微溶于水,出现浑浊,说明碳酸的酸性大于苯酚.
解答 解:(1)乙醛与氧气发生氧化反应生成乙酸,方程式为:2CH3CHO+O2$→_{68℃~80℃}^{cuo}$2CH3COOH,故答案为:2CH3CHO+O2$→_{68℃~80℃}^{cuo}$2CH3COOH;
(2)实验开始时温度计应测量反应溶液的温度,控制反应温度为60℃~80℃,温度计水银球的位置应在试管A的反应液中;由蒸馏原理可知,温度计测量的是蒸气的温度,收集得到乙酸,温度计水银球的位置应在试管A的支管口处,
故答案为:测量反应溶液的温度;在试管A的支管口处;收集含乙酸的馏分;
(3)烧杯B的作用是:①使试管A内的反应液均匀受热发生反应,②使生成的乙酸蒸气进入试管;乙酸的沸点为117.9℃,若通过蒸馏的方法得到乙酸,B内盛装的液体的沸点应大于117.9℃,由表可知烧杯B内盛装的液体可以是乙二醇或甘油;
故答案为:使生成的乙酸蒸气进入试管;乙二醇或甘油;
(4)乙酸能使PH试纸变红,乙酸能与碳酸氢钠粉末反应产生气泡,与红色石蕊试纸、白色的醋酸铅试纸无现象;故选:ad;
(5)乙酸和碳酸钠反应生成二氧化碳,说明乙酸的酸性大于碳酸,乙酸易挥发,导致二氧化碳中含有乙酸,用饱和碳酸氢钠溶液除去乙酸,二氧化碳和苯酚钠溶液反应生成苯酚和碳酸氢钠,方程式为:C6H5ONa+CO2+H2O→C6H5OH↓+NaHCO3,苯酚微溶于水,出现浑浊,说明碳酸的酸性大于苯酚;
故答案为:①除去乙酸;②溶液变浑浊;C6H5ONa+CO2+H2O→C6H5OH↓+NaHCO3.
点评 本题借助于乙酸的制备,考查了蒸馏的原理、温度计的使用,乙酸的性质及检验质,难度不大,根据课本知识即可完成,注意总结温度计在不同反应中的位置.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.25mol | B. | 0.5mol | C. | 1mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1=10V2 | B. | V1>10V2 | C. | V1<10V2 | D. | V2>10V1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人工肾脏可用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),原理如图.
人工肾脏可用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),原理如图.查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | U形管内红色褪去 | B. | 试管内溶液变红 | C. | 气球a被吹大 | D. | U形管水位d<c |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 |  | 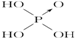 |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 ,亚砷酸
,亚砷酸 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Cl2+2KBr═2KCl+Br2所以F2也能与KBr溶液反应置换出Br2 | |
| B. | 常温下,由Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,所以Fe也能与浓硝酸反应产生NO2 | |
| C. | 由Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2 所以Cu+I2$\frac{\underline{\;\;△\;\;}}{\;}$CuI2 | |
| D. | 由钠保存在煤油中,所以钾也可以保存在煤油中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com