
【题目】钛合金材料在航海航天等工业有十分重要的用途。钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化。由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图所示。
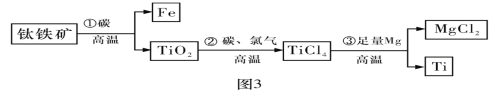
请回答下列问题:
(1)步骤①发生氧化还原反应,其氧化剂是___________。
(2)步骤②中发生的化学反应方程式为____________________________________________。
(3)步骤③需在氩气环境中进行,目的是__________________________________________。
(4)金属钛中常混有少量镁,提纯时可用稀硫酸除去少量的镁,其理由是___________________________________________________________。
【答案】FeO ![]() 防止钛、镁在高温下被空气氧化(或防止金属被空气氧化) 钛(Ti)常温下与酸、碱均不反应,镁能与稀硫酸反应(回答合理可给分)
防止钛、镁在高温下被空气氧化(或防止金属被空气氧化) 钛(Ti)常温下与酸、碱均不反应,镁能与稀硫酸反应(回答合理可给分)
【解析】
根据流程图可知,钛铁矿(主要成分是FeO和TiO2),与C在高温下发生氧化还原反应,生成Fe,说明C只还原了FeO。TiO2在高温下与C和Cl2反应,生成TiCl4,然后加Mg高温还原,得到Ti单质。
(1)根据分析,步骤①中C还原了FeO,FeO是氧化剂;
(2)步骤②反应物为TiO2、C、Cl2,生成物为TiCl4,C被氧化成CO,发生的化学反应方程式为![]() ;
;
(3)由于Ti和Mg都是金属,高温下容易被空气氧化,所以在氩气环境中进行可以防止Ti、Mg在高温下被空气氧化;
(4)由于钛(Ti)常温下与酸、碱均不反应,加入的稀硫酸只与Mg反应,反应后可以过滤除去含有Mg的溶液。


科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表得第_____________族,其基态原子中未成对电子的个数为______。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为________,所含非金属元素的第一电离能由大到小的顺序是_________。
(3)尿素分子中碳原子为________杂化,分子中σ键与π键的数目之比为_____。
(4)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20 .5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_______(填晶体类型)。
(5)血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和血红素的结构如图所示。
吡咯![]() 血红素
血红素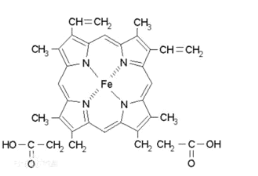
①1 mol吡咯分子中所含的σ键总数为____个。(用NA表示阿伏加德罗常数的值)分子中的大π键可用![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为____ 。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为____ 。
②血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过____键相结合。
③血红素中N的杂化方式为______________,请画出血红素中N与Fe的配位键_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是_______。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______ (填元素符号),判断的实验依据是________________________________________________(写出一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请用物质的组号填写下表。
类型 | 同位素 | 同素异形体 | 同分异构体 | 同系物 |
组号 | _____ | _____ | _____ | _____ |
①CH(CH3)3和CH3CH2CH(CH3)2
②C(CH3)4和CH3CH2CH(CH3)2
③CH4和CH3CH2CH3
④金刚石和石墨
⑤H、D、T
⑥12C、13C、14C
⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3)
⑧臭氧(18O3)和氧气(16O18O )
⑨ 和
和
⑩ H216O和H218O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl、CO32、SO42,现取三份各100mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生
②第二份加过量NaOH溶液加热后,只收集到气体0.02mol,最终无沉淀生成,同时得到溶液甲
③在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g
④第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g
下列说法不正确的是( )
A.原溶液中一定不存在的离子为Fe3+、Mg2+、CO32、Ba2+
B.c(SO42)=0.5mol/L
C.无法判断原溶液中是否存在Cl
D.无法判断原溶液中是否存在K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要200mL 0.100mol·L-1 NaOH溶液,配制时的部分实验操作如图所示,下列说法正确的是( )
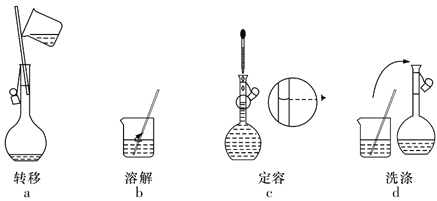
A.实验中需用到的玻璃仪器有:100mL容量瓶、烧杯、玻璃棒、胶头滴管等
B.实验操作步骤的正确顺序为dabc
C.容量瓶需要用自来水洗涤,干燥后才可用
D.定容时,若俯视容量瓶的刻度线,则使配得的NaOH溶液浓度偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的每个字母代表一种元素,请根据要求回答问题。
族 周期 | ⅠA | 0 | |||||||
1 | a | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | b | c | d | ||||||
3 | e | f | g |
(1)元素g在元素周期表的位置为____________________。
(2)b和g两种元素的原子半径大小关系:b______g(填“>”或“<”).
(3)由原子个数比为1:1:1的a、b、c三种元素组成的共价化合物X,共形成4对共用电子对,则X的结构式为______________。
(4)f的最高价氧化物与e的最高价氧化物对应的水化物在溶液中反应的离子方程式为_________________________。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答:
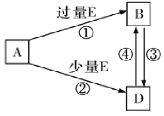
①E的电子式为_______________,B的化学式为____________________。
②A中的化学键类型为____________________
③自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶液中金属阳离子的浓度为0.5mo/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俄罗斯用“质子—M”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
(1)H2(g)=H2(l) △H1=-0.92kJ·mol-1
(2)O2(g)=O2(l) △H2=-6.84kJ·mol-1
(3)如图:
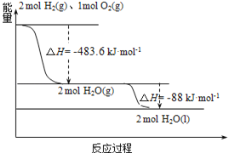
下列说法正确的是( )
A. 2mol H2(g)与1molO2(g)所具有的总能量比2molH2O(g)所具有的总能量低
B. 火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)=2H2O(g) △H=-474.92kJ·mol-1
C. 氢气的燃烧热为△H=-241.8kJ·mol-1
D. H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将50g溶质质量分数为ω1,物质的量浓度为c1的较浓氨水沿玻璃棒加入到VmL水中,稀释后得到溶质质量分数为ω2,物质的量浓度为c2的稀氨水。若c1=2c2,则( )
A.ω1>2ω2,V>50
B.ω1<2ω2,V<50
C.ω1=2ω2,V<50
D.ω1>2ω2,V<50
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com