
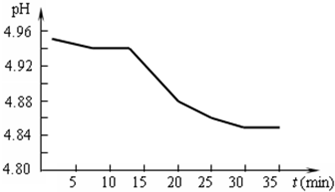
| 1 |
| x |
| 1 |
| x |
| 3 |
| x |
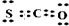
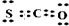


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.用天然气代替煤炭作民用燃料 |
| B.大力植树造林 |
| C.硫酸厂采取措施提高尾气的吸收率 |
| D.燃煤中加入生石灰 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.二氧化硫、二氧化氮和二氧化碳都是形成酸雨的物质 |
| B.用高锰酸钾溶液吸收水果产生的乙烯,能达到保鲜的目的 |
| C.金属锂是最轻的金属,且活动性强,是制造电池的理想物质 |
| D.含氮、磷的大量污水任意排放是造成水华、赤潮等水体污染的重要原因 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.6 | 4.3 | 4.2 | 4.0 | 4.0 |
查看答案和解析>>
科目:高中化学 来源:同步题 题型:计算题
查看答案和解析>>
科目:高中化学 来源:河北省期末题 题型:不定项选择题

[ ]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com