
| A. | 沸点:己烷>2-甲基丁烷>戊烷 | B. | 同分异构体种类:戊烷<戊烯 | ||
| C. | 密度:苯<水<1,1,2,2-四溴乙烷 | D. | 点燃时火焰明亮程度:乙烯>乙烷 |
分析 A.烃类物质中,烃含有的C原子数目越多,相对分子质量越大,熔沸点越高,同分异构体分子中,烃含有的支链越多,熔沸点越小;
B.戊烯不但有碳链异构,还有官能团异构和位置异构;
C.苯的密度小于1g/mL、水的密度是1g/mL、1,1,2,2-四溴乙烷的密度大于1g/mL;
D.含碳量越高火焰越明亮.
解答 解:A.己烷中含有6个C,2-甲基丁烷和戊烷含有5个C,戊烷没有支链,所以沸点:己烷>戊烷>2-甲基丁烷,故A错误;
B.戊烷只有碳链异构,戊烯不但有碳链异构,还有官能团异构和位置异构,故同分异构体种类戊烷<戊烯,故B正确;
C.苯的密度小于1g/mL、水的密度是1g/mL、1,1,2,2-四溴乙烷的密度大于1g/mL,所以密度苯<水<1,1,2,2-四溴乙烷,故C正确;
D.乙烯含碳量高于乙烷,所以点燃时火焰明亮程度:乙烯>乙烷,故D正确;
故选:A.
点评 本题考查物质的性质比较,熟悉影响有机物沸点的原因、影响同分异构体种类的因素和有机物的密度是解答本题的关键,注意归纳规律性知识来解答,难度不大.


科目:高中化学 来源: 题型:实验题
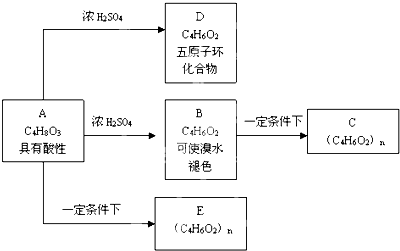
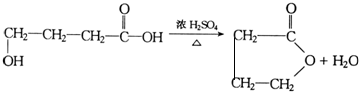

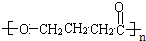 +nH2O
+nH2O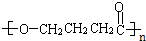 ;
;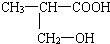 及
及 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 | |
| B. | 实验室从海带提取碘单质的步骤是:取样、灼烧、溶解、过滤、萃取 | |
| C. | 金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 | |
| D. | 中和滴定实验中,如用于盛放待测液的锥形瓶洗净后未经干燥,不影响测定结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、H2O、NH4Cl | B. | KOH、Na2O2、NH4Cl | ||
| C. | MgO、CaBr2、NaCl | D. | Na2SO4、HCl、MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H3PO4>H2SO4 | B. | 氢化物稳定性:HF>H2O>NH3 | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 氧化性:F2>O2>N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
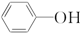 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子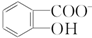 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是 中形成分子内氢键,使其更难电离出H+;水杨酸分子中苯环和羧基上碳原子的杂化方式分别是sp2杂化和sp2杂化.
中形成分子内氢键,使其更难电离出H+;水杨酸分子中苯环和羧基上碳原子的杂化方式分别是sp2杂化和sp2杂化.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com