
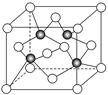
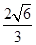
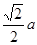 。而紧邻As、Ga间距离请想象一个正方体内接正四面体,经过简单计算可知正四面体体心为正方体体心,位于正方体体对角线中点处。把上述晶胞拆成8个等大的小立方体,可以发现其中4个的体心位置有Ga原子填充。小立方体的棱长为0.5a,则其体对角线长是
。而紧邻As、Ga间距离请想象一个正方体内接正四面体,经过简单计算可知正四面体体心为正方体体心,位于正方体体对角线中点处。把上述晶胞拆成8个等大的小立方体,可以发现其中4个的体心位置有Ga原子填充。小立方体的棱长为0.5a,则其体对角线长是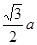 ,可得As、Ga间距为
,可得As、Ga间距为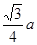 ,综上所诉,该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为
,综上所诉,该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为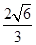 。
。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:不详 题型:单选题
| A.原子半径: A>B>D>C | B.原子序数: d>c>b>a |
| C.离子半径: C>D>B>A | D.单质的还原性: A>B>D>C |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2Te > H2Se > H2S > H2O | B.KCl>NaCl>LiCl>HCl |
| C.Sr>Ba>Ca>Be | D.金刚石>SiC>晶体硅 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
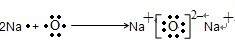

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.53135I是碘的一种同素异形体 | B.53135I是一种新发现的元素 |
| C.53135I位于元素周期表中第四周期ⅦA族 | D.53135I核内的中子数与核外电子数之差为29 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A | | C |
| | B | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
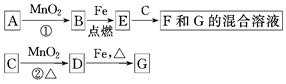
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com