
����Ŀ��ij��ȤС����ͨ��ʵ�鷽����֤Fe2+��ijЩ���ʣ�
��1����ʵ��ǰ������Fe2+���ԣ���д�������
ʵ����� | Ԥ������ | ��Ӧ�����ӷ���ʽ |
��ʢ���¸�FeSO4��Һ���Թ��е�������Ũ���ᣬ�� | �Թ��в�������ɫ���壬��Һ��ɫ��� | Fe2++NO3��+2H+=Fe3++NO2��+H2O |
���ձ��в�������С�����ʵ�飮�۲쵽Һ���Ϸ�������Ϊ����ɫ�����Թ�����Һ��ɫȴ��Ϊ����ɫ��
��2���ֱ�ȡ������Ӧ�����Һ����ֻ�Թ��У�һֻ�μӼ���KSCN��Һ����Һ��Ϊ��죬����Һ�к�������һֻ�ԹܵμӼ�����Һ��������ɫ����������Fe2+ ��
��3����С��������Ϊ����ɫ������NO2��NO������ijһ�����ӷ�����Ӧ����ģ�
������룺
����NO2��Fe2+������Ӧ����NO2 ��Fe3+������Ӧ
����NO��Fe2+������Ӧ����
��4����С������ͼװ�ý���̽���� 
���� | ���������� | ���ͻ���� |
�� | �ر�k��b����a����ʼ���з�Ӧ��һ��ʱ��۲쵽������Һ��Ϊ����ɫ����������Һ�����Ա仯 | ��Һ����ɫ����NO��NO2��Ӧ���ĵõ� |
�� | ֹͣ���з�Ӧ����k��b���ر�a������ͨ��N2һ��ʱ�� | �ò�����Ŀ�� |
�� | �����µı�����װ�ã���ͨһ��ʱ��N2��ر�k��ʹ���з�Ӧ�������۲쵽�������벽�������ͬ | ��ƿ�з����Ļ�ѧ��Ӧ����ʽΪ |
��5�����ʵ����룬�ó����ۣ�
��Һ������ɫ��ԭ�϶��������Dz�������ȷ�����Dz��� �� �д�����ʵ���һ��̽����
���𰸡�
��1����ԭ
��2��Fe3+��K3[Fe��CN��6]
��3��NO��Fe3+������Ӧ
��4��Fe2+���ž���װ�ü��������е�NO2��3NO2+H2O=2HNO3+NO
��5������i
���������⣺��1�������ӷ���ʽFe2++NO3��+2H+=Fe3++NO2+H2O�У�Fe2+������ΪFe3+ �� ��ʾ��ԭ�ԣ����Դ��ǣ���ԭ����2����Ӧ����Һ�о�����KSCN��Һ��죬�ʿ���˵����������ὫFe2+����Ϊ��Fe3+ �� Fe2+��K3[Fe��CN��6]������ɫ���������Դ��ǣ�Fe3+��K3[Fe��CN��6]����3������һ�ֲ���ΪNO ��Fe3+������Ӧ�����Դ��ǣ�NO ��Fe3+������Ӧ����4���ٴ���a���ر�k��bʱ����Ӧ���ɵ�NO2����ͨ����FeSO4��Һ�к�������ɫ����ͨ��Fe2��SO4��3��Һ�����������Դ��ǣ�Fe2+��
�ڴ���k��b���ر�a��ʹNO2��ˮ��Ӧ����NO�����Դ��ǣ��ž���װ�ü��������е�NO2����Ϊ�����ʵ����ж��գ�������������ʹ���з�Ӧ�������۲쵽�������벽�������ͬ��3NO2+H2O=2HNO3+NO����NOͨ��FeSO4��Һ��������ɫ�����Դ��ǣ�3NO2+H2O=2HNO3+NO����5�����ʵ����뼰ʵ��٢ڢۿ�֪����Һ������ɫ��ԭ���Dz��뢣����ȷ�����Dz�����i�����Դ��ǣ�����i��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3��g����5O2��g�� ![]() 4NO��g����6H2O��g��������������ȷ����
4NO��g����6H2O��g��������������ȷ����
A. �ﵽ��ѧƽ��ʱ4v����O2����5v����NO��
B. ����λʱ��������x mol NO��ͬʱ������x mol NH3,��Ӧ�ﵽƽ��״̬
C. �ﵽ��ѧƽ��ʱ�������������ݻ���������Ӧ���ʼ�С���淴Ӧ��������
D. ��ѧ��Ӧ���ʹ�ϵ��2v����NH3����3v����H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͪ����Ҫ����ԭ�ϣ����������������������ͼ��������Ҫ�м��壮ʵ���ҳ��ø��������������Ʊ���������Ϲ�����Ⱦ������ij��ѧ��Ȥ��ȤС�鳢������ѧ��ѧ�������Ĵ������ƴ�������Ʊ�����ͪ���й�������Ϣ��ʵ��������ͼ1��ʵ��װ����ͼ2���£�����ͪ����ɫ��dz��ɫ��Һ�壬��ǿ�ҵĴ̼��Գ�ζ�����ˮ���ܶȣ�0.95���۵㣺��45�棬�е㣺155�棬�ܽ�ȣ�100mL H2O����2.4g ��31�� ����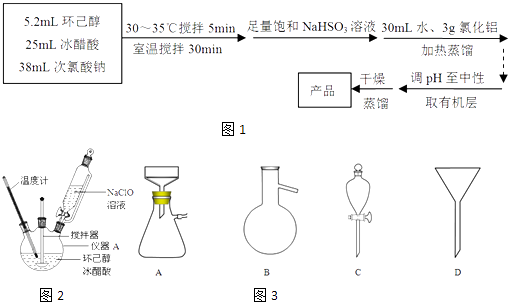 �ش��������⣺
�ش��������⣺
��1������A�������� ��
��2���ڷ�Ӧ��ʼ��5min��Ϊ�˽���ϵ�¶�ά����30��35�棬�����ñ�ˮԡ��ȴ�⣬��ȡ�Ĵ�ʩ������ ��
��3�����뱥��NaHSO3��Һʱ��������Ҫ��Ӧ���������ӷ���ʽ��ʾ����ȷ������ı���NaHSO3��Һ�Ѿ�������ʵ������� ��
��4��Ϊ�����Һ��pH�������ԣ����Լ�����Լ��� ��
A.ϡ����
B.��ˮ̼����
C.Ũ����
D.�������ƹ���
��5������pH������뾫��ʳ�Σ���Ŀ���� �� ��ȡ�л��㡱ʱʹ�õ���Ҫ������ �� ����ͼ3��Ӧ����ĸ����
��6��ʵ���������Ż���ʵ��ɰ�������Ҫ��С���Ա�����б�Ҫ��NaClO��Һ�����Ũ�Ƚ���̽��������������һϵ�в�ͬŨ�ȵ�NaClO��Һ�����õζ����궨�����巽���ǣ�����Һ��ȡ10.00mL NaClO��Һ��500mL����ƿ�ж��ݣ�ȡ25.00mL����ƿ�У���������ϡ�����KI���壨����������0.1000mol/L Na2S2O3����Һ�ζ����յ㣨�õ�����Һ��ָʾ����������ƽ��ʵ��ƽ������Na2S2O3����Һ18.00mL����֪I2+2Na2S2O3�T2NaI+Na2S4O6 �� ���NaClO��Һ��Ũ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȼ����ڸ߿��������߷���ʱ����Cl��ԭ�ӣ����ܷ������з�Ӧ��Cl����O3�D��ClO����O2 �� ClO����O���D��Cl����O2������˵������ȷ����(����)
A.��Ӧ�����н�O3ת��ΪO2
B.Cl���ܷ�Ӧ�Ĵ���
C.���ȼ������ܷ�Ӧ�Ĵ���
D.Cl��ֽ�O3������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I���������Ժʿ����Ժʿѧ��ͬ���ġ����ӹ��������ն�����������ˣ�ȫ������������Ϸ˵��BF3��TiO2��CH3COOH��CO2��NO����ï����NH3��HCN��H2S��O3�������ϩ���Ƶ��ڶࡰ���ӹ������е����ǣ�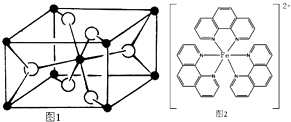
��1��д��Fe2+�ĺ�������Ų�ʽ ��
��2������˵����ȷ���� ��
a��H2S��O3���Ӷ���ֱ����
b��BF3��NH3���Ǻ��м��Լ��ķǼ��Է���
c��CO2��HCN���ӵĽṹʽ�ֱ��ǣ�O=C=O��H��C��N
d��CH3COOH������̼ԭ�ӵ��ӻ���ʽ�У�sp2��sp3
��3��NO�������е��źŷ��ӣ��й�˵����ȷ�� ��
a��ԭ�Ӱ뾶N����O b���ǽ�����O����N
c��NO+�ĽṹʽΪ����N��O��+ d��NO�γɵľ����Ƿ��Ӿ���
��4��TiO2����Ȼ�����У����ȶ���һ�־���ṹ��ͼ1�������ʾԭ�ӣ�
��5�������۷е�ܸߣ������ڴ����Է��Ӽ�����ϵĶ����壨��һ����״�ṹ�����뻭���������Ľṹ�� ��
��6����ï����C5H5��2Fe��Fe2+�뻷���ϩ���γɵ�һ�����
�ʵ���Ҳⶨ���ĺ�����������λ���ڶ�����
�� ![]() ����������Fe2+�γɺ�ɫ��������ͼ2����
����������Fe2+�γɺ�ɫ��������ͼ2����
����������Fe2+�뵪ԭ���γ���λ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��3NO2+H2O�T2HNO3+NO���ش��������⣺
��1���÷�Ӧ�����ӷ���ʽΪ
��2���������뻹ԭ����������Ϊ ��
��3���ڱ�״���£�336mL NO2��H2O��ȫ��Ӧת�Ƶĵ�����ĿΪ �� ������������Һ���Ϊ60mL�������Һ�����ʵ���Ũ��Ϊ
��4������ƽ���»�ѧ����ʽ��FeSO4+HNO3��ϡ����Fe2��SO4��3+Fe��NO3��3+NO��+H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��������ʻ�Ӧ�õ�˵����ȷ����
A. ҽ���ϣ�����̼��������θ�����
B. �ں�������ϰ�װп���Լ������帯ʴ
C. Һ�������ų��������ȣ������������
D. ��������ǿ�����ԣ�����������ˮ��ɱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ����
A.�������Һ����Ϊ��ѧ�仯
B.Na��SiO2��H2O����Ϊ����ʽ
C.NH3��ˮ��Һ�ܵ��磬����NH3Ϊ�����
D.HClO��KNO3��H2O2�о������Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ������ԭ�������������������Ԫ��A��B��D��X��Y��Z����̬ʱ��������Ų���������������A�ĵ��Ӳ�����������������ȣ��ǽ���Ԫ��B���ѳɶԵ�������δ�ɶԵ�������2������A��Bλ�ڲ�ͬ���ڣ�D��X�ļ۵��Ӳ���δ�ɶԵ��Ӿ�ֻ��1��������D����X+�ĵ������Ϊ8��Y��Z��Xλ��ͬһ���ڣ����Ǽ۵��Ӳ��е�δ�ɶԵ������ֱ�Ϊ4��2����ԭ���������Ϊ2���ش��������⣺
��1��Z2+�ļ۲�����Ų�ʽΪ ��
��2��D��X��Y����Ԫ���е�һ�����ܴӴ�С��˳���� �� ����Ԫ�ط��ţ�
��3������ʽΪAD�Ļ����ﳣ�Զ���壨AD��n����ʽ���ڣ������ԭ�� ��
��4��B�͵�ԭ�ӿ��γɻ����BN��2 �� ��BN��2����������ԭ�ӵ��ӻ���ʽΪ �� �ռ��ͦм��ĸ���֮��Ϊ �� �ռ乹��Ϊ ��
��5��D����X+��Y3+����������ɵĻ�����X3YD6 �� ���л�ѧ�������������û������д���һ���������ӣ������ӵĻ�ѧʽΪ �� ��λ���� ��
��6��Y����ľ�����ͼ��ʾ�������߳�Ϊapm����Y����λ��Ϊ �� ������ܶ�Ϊg/cm3 �� ����NA ��ʾ����٤��������ֵ��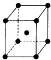
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com