
| 起始加入量(mol) | 平衡时 | ||||
| A | B | C | A或C转化率(%) | C的物质的量分数(%) | 放出或吸收热量(KJ) |
| 1 | 1 | 0 | α1 | φ1 | Q1 |
| 0 | 0 | 2 | α2 | φ2 | Q2 |
| 2 | 2 | 0 | α2 | φ3 | Q3 |
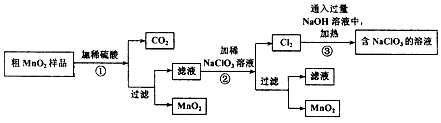
分析 I.粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品中加入过量的稀硫酸,由于MnO2不溶于硫酸,则样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,过滤得滤液为硫酸锰溶液,加入NaClO3发生反应为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,再过滤得到滤液和二氧化锰固体,而氯气与热的氢氧化钠反应生成氯酸钠方程式为:3Cl2+6NaOH=NaClO3+NaCl+3H2O.
(1)MnO2不溶于硫酸,MnO和硫酸反应生成硫酸锰和水,碳酸锰与硫酸反应生成硫酸锰和二氧化碳、和水;
(2)氧化性:ClO3->Mn2+,以NaClO3为氧化剂,NaClO3氧化MnSO4生成氯气和二氧化锰,根据得失电子守恒、原子守恒书写;
(3)第④步操作中NaOH过量,结合方程式分析;
(4)根据洗涤沉淀的方法选择洗涤的仪器,若沉淀没有洗涤干净,则滤液中含有硫酸根离子;检验沉淀是否完全的方法是取上层清液加入氯化钡溶液检验硫酸根离子是否存在;
(5)根据方程式NaClO3+6HCl(浓)═NaCl+3Cl2↑+3H2O、MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,进行计算;
(6)电解时,Mn2+在阳极失电子生成MnO2.
II.(7)通入CO2,可使K2MnO4发生歧化反应生成KMnO4和MnO2,反应中MnO42-→MnO4-,Mn元素化合价由+6价升高为+7,化合价总共升高1价,MnO42-→MnO2,Mn元素化合价由+6价降低为+4,化合价总共降低2价,化合价升高最小公倍数为2,故MnO4-系数为2,MnO2系数为1,根据锰元素守恒可知,转化KMnO4的MnO42-占$\frac{2}{3}$;
(8)①草酸根离子具有还原性,把MnO4-还原为Mn2+,根据化合价升降方法,反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,C2O42-→CO2,碳元素化合价由+3价升高为+4,共升高2价,化合价最小公倍数为10,故MnO4-系数为2,C2O42-系数为5,再根据元素守恒、电荷守恒确定其它物质的系数;
②反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好.
解答 解:I.(1)粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品中加入过量的稀硫酸,由于MnO2不溶于硫酸,则样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,反应为:MnO+H2SO4=MnSO4+H2O、MnCO3+H2SO4=MnSO4+H2O+CO2↑,
故答案为:MnCO3+H2SO4=MnSO4+H2O+CO2↑;
(2)NaClO3氧化MnSO4生成氯气和二氧化锰,Cl(+5→0),Mn(+2→+4),最小公倍数为10,离子反应为:2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+,
故答案为:2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+;
(3)第④步操作中NaOH过量,发生的反应为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,则最终得到的固体除NaClO3外,还有NaOH和NaCl;
故答案为:ad;
(4)将沉淀放在过滤装置中的滤纸上,加蒸馏水浸没沉淀,使水自然流下,重复2-3次即可,所以需用的玻璃仪器有烧杯、漏斗、玻璃棒,若沉淀没有洗涤干净,则滤液中含有硫酸根离子,检验硫酸根离子选用氯化钡溶液;检验沉淀是否完全的方法是取上层清液加入BaCl2溶液,如果再产生沉淀,说明沉淀没有洗涤干净,反之洗净,
故答案为:烧杯、漏斗、玻璃棒;BaCl2;
(5)NaClO3+6HCl(浓)═NaCl+3Cl2↑+3H2O、MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,假设都生成3mol氯气时,需消耗NaClO3与MnO2的物质的量分别是1mol、3mol,所以制取等量的氯气消耗NaClO3与MnO2的物质的量之比为1:3,
故答案为:1:3;
(6)电解时,Mn2+在阳极失电子生成MnO2,其电极方程式为Mn2+-2e-+2H2O=MnO2+4H+;
故答案为:Mn2+-2e-+2H2O=MnO2+4H+.
II.(7)CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,反应的离子方程式为:3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-;反应中MnO42-→MnO4-,Mn元素化合价由+6价升高为+7,化合价总共升高1价,MnO42-→MnO2,Mn元素化合价由+6价降低为+4,化合价总共降低2价,化合价升高最小公倍数为2,故MnO4-系数为2,MnO2系数为1,根据锰元素守恒MnO42-系数为3,所以转化KMnO4的MnO42-占$\frac{2}{3}$,故K2MnO4完全反应时转化为KMnO4的百分率约$\frac{2}{3}$×100%=66.7%,
故答案为:66.7%;
(8)①反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,C2O42-→CO2,碳元素化合价由+3价升高为+4,共升高2价,化合价最小公倍数为10,故MnO4-系数为2,C2O42-系数为5,再根据元素守恒可知Mn2+系数为2、CO2系数为10,根据电荷守恒可知H+系数为16,根据氢元素守恒可知H2O系数为8,配平后离子方程式为2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,
故答案为:2;5;16H+;2;10;8H2O;
②反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好,
故答案为:反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好.
点评 本题考查物质的制备、分离与提纯、氧化还原反应配平、化学计算等,题目难度中等,把握流程中发生的化学反应及电解池原理为解答的关键,注意掌握化学实验基本操作方法,需要学生具备一定的理论分析能力和计算解决问题的能力.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案科目:高中化学 来源: 题型:填空题
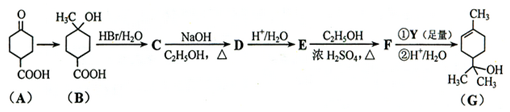
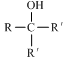
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
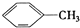
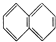
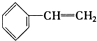
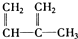
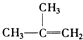
| A. | ④和⑧ | B. | ①、②和③ | C. | ④和⑤ | D. | ④、⑥和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 受热时,NaHCO3比Na2CO3容易分解 | |
| B. | NaHCO3俗名苏打,Na2CO3俗名纯碱 | |
| C. | NaHCO3溶液显酸性,Na2CO3溶液显碱性 | |
| D. | NaHCO3和Na2CO3各1mol分别与过量盐酸反应,产生CO2的质量不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
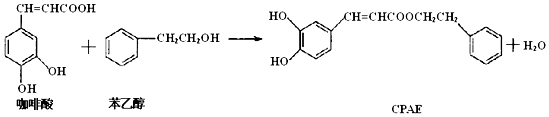
| A. | 咖啡酸分子中所有碳原子可能处在同一个平面上 | |
| B. | 1 mol CPAE与足量的溴水反应,最多消耗3molBr2 | |
| C. | 1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2 | |
| D. | 1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则反应( )
在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则反应( )| A. | 正反应放热,L是固体 | B. | 正反应放热,L是气体 | ||
| C. | 正反应吸热,L是气体 | D. | 正反应吸热,L是固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com