
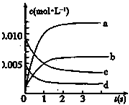
 在2L密闭容器内,800℃时反应:2XY (g)+Y2(g)?2XY2(g)体系中,n(XY)随时间的变化如表:
在2L密闭容器内,800℃时反应:2XY (g)+Y2(g)?2XY2(g)体系中,n(XY)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(XY)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
分析 (1)平衡常数表达式等于生成物的浓度幂之积比上反应物的浓度幂之积;
(2)根据表格知,随着反应的进行,XY的物质的量减小,则平衡向正反应方向移动,XY2的物质的量逐渐增大,根据XY和XY2之间转化关系式计算平衡时XY2的物质的量,从而确定曲线;先计算XY的反应速率,再根据同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比计算Y2的反应速率;
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变.
解答 解:(1)平衡常数表达式等于生成物的浓度幂之积比上反应物的浓度幂之积,K=$\frac{c(XY{\;}_{2}){\;}^{2}}{c(XY){\;}^{2}c(Y{\;}_{2})}$,故答案为:$\frac{c(XY{\;}_{2}){\;}^{2}}{c(XY){\;}^{2}c(Y{\;}_{2})}$;
(2)根据表格知,随着反应的进行,XY的物质的量减小,则平衡向正反应方向移动,XY2的物质的量逐渐增大,当反应达到平衡状态时,参加反应的n(XY)=(0.020-0.007)mol=0.013mol,根据XY和XY2之间转化关系式知,平衡状态时生成n(XY2)等于参加反应的n(XY),所以为0.013mol,c(XY2)=$\frac{0.013mol}{2L}$,故选b;
0~2s时,v(XY)=$\frac{\frac{(0.020-0.008)mol}{2L}}{2s}$=0.003mol/(L.s),同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(Y2)=$\frac{1}{2}$v(XY)=0.0015mol•L-1•S-1,
故答案为:b;0.0015mol•L-1•S-1;
(3)A、当v (XY2)=2v (Y2)时,没有指明正逆方向,该反应不一定达到平衡状态,故错误;
B、该反应是一个反应气体气体体积改变的可逆反应,当达到平衡状态时,各物质的浓度不变,则容器内压强保持不变,故正确;
C、XY、Y2、XY2的浓度之比为2:1:2,浓度之比等于系数之比,不能说明正逆反应速率相同,不能说明达到化学平衡,故错误;
D、根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,所以不能据此判断是否达到平衡状态,故错误;
故选B.
点评 本题考查了化学平衡状态的判断、化学反应速率的计算等知识点,根据v=$\frac{△c}{△t}$、v(正)=v(逆)来分析解答即可,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、HCO3-、AlO2- | ||
| C. | NO3-、K+、AlO2-、OH-? | D. | NO3-、Mg2+、K+、CH3COO-? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 用溴水即可鉴别苯酚溶液,2,4-己二烯和甲苯 | |
| C. | 乙酸乙酯和食用植物油均可水解生成乙醇 | |
| D. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片加入稀盐酸中:Cu+2H+=Cu2++H2↑ | |
| B. | 盐酸滴加在石灰石上:CO32-+2H+=H2O+CO2↑ | |
| C. | 氢氧化钡溶液与稀硫酸混合:Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-+Cu2++2 OH-=BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
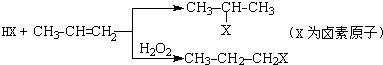
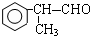 的物质,该物质是一种香料.
的物质,该物质是一种香料.
 、
、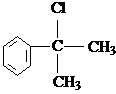 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$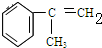 +NaCl+H2O.
+NaCl+H2O. +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2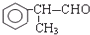 +2H2O.
+2H2O.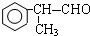 有多种同分异构体,满足下列条件:(1)苯环上一卤代物有两种,(2)属于醛类的同分异构体有4种.
有多种同分异构体,满足下列条件:(1)苯环上一卤代物有两种,(2)属于醛类的同分异构体有4种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com