
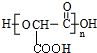 +(n-1)H2O.
+(n-1)H2O.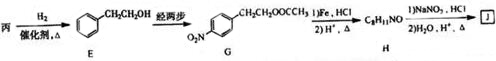
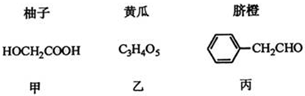
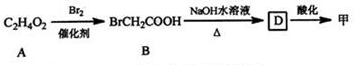
分析 (1)由A的分子式、B的结构可知,A与溴发生取代反应生成B,则A为CH3COOH,B在碱性条件下发生水解反应、中和反应得到D为HOCH2COONa,D酸化得到甲;
(2)1mol乙消耗NaHCO3的物质的量是甲的2倍,则乙分子中含有2个羧基,乙在一定条件下生成链状脂类有机高分子化合物,则乙为HOOCCH(OH)COOH,得到的高分子化合物为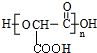 ;
;
(3)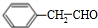 与氢气发生加成反应生成
与氢气发生加成反应生成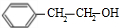 ,E经过硝化反应、酯化反应得到G,G发生信息③中转化得到H为
,E经过硝化反应、酯化反应得到G,G发生信息③中转化得到H为 ,J为
,J为 .
.
解答 解:(1)由A的分子式、B的结构可知,A与溴发生取代反应生成B,则A为CH3COOH,B在碱性条件下发生水解反应、中和反应得到D为HOCH2COONa,D酸化得到甲,
①甲中含有不饱和键的官能团名称为:羧基,故答案为:羧基;
②A→B为取代反应,A的结构简式为:CH3COOH,故答案为:CH3COOH;
③B→D的化学方程式为:BrCH2COOH+2NaOH$→_{△}^{水}$HOCH2COONa+NaBr+H2O,
故答案为:BrCH2COOH+2NaOH$→_{△}^{水}$HOCH2COONa+NaBr+H2O;
(2)1mol乙消耗NaHCO3的物质的量是甲的2倍,则乙分子中含有2个羧基,乙在一定条件下生成链状脂类有机高分子化合物,则乙为HOOCCH(OH)COOH,得到的高分子化合物为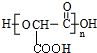 ,反应方程式为:n HOOCCH(OH)COOH$\stackrel{一定条件}{→}$
,反应方程式为:n HOOCCH(OH)COOH$\stackrel{一定条件}{→}$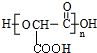 +(n-1)H2O,
+(n-1)H2O,
故答案为:n HOOCCH(OH)COOH$\stackrel{一定条件}{→}$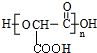 +(n-1)H2O;
+(n-1)H2O;
(3)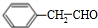 与氢气发生加成反应生成
与氢气发生加成反应生成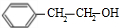 ,E经过硝化反应、酯化反应得到G,G发生信息③中转化得到H为
,E经过硝化反应、酯化反应得到G,G发生信息③中转化得到H为 ,J为
,J为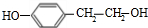 .
.
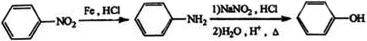
①用化学方法除去E中残留的少量丙,第1步加入试剂的名称为新制氢氧化铜或银氨溶液,第2、3步操作分别是过滤、分液,故答案为:新制氢氧化铜或银氨溶液;
②经E→G→H保护的官能团是羟基,可以表征有机化合物中存在何种官能团的仪器是红外光谱仪,
故答案为:羟基;红外光谱仪;
③J(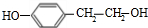 )的同分异构体中在核磁共振氢谱上显示为两组峰,峰面积比为3:2的链状且不存在支链的异构体,分子中含有2个-CH3、2个-CH2-,且为对称结构,可能的结构简式为:
)的同分异构体中在核磁共振氢谱上显示为两组峰,峰面积比为3:2的链状且不存在支链的异构体,分子中含有2个-CH3、2个-CH2-,且为对称结构,可能的结构简式为:
CH3CH2COC≡CCOCH2CH3,CH3COCH2C≡CCH2COCH3,
CH3CH2OC≡C-C≡COCH2CH3,CH3OCH2C≡C-C≡CCH2OCH3,
CH3OC≡CCH2-CH2C≡COCH3,CH3C≡COCH2-CH2OC≡CCH3,
CH3C≡CCH2OOCH2C≡CCH3,CH3CH2C≡COOC≡CCH2CH3,
共有8种,其中某异构体L中的官能团都能与H2发生加成反应,则L的结构简式为 CH3CH2COC≡CCOCH2CH3,CH3COCH2C≡CCH2COCH3,
故答案为:8;CH3CH2COC≡CCOCH2CH3或CH3COCH2C≡CCH2COCH3.
点评 本题考查有机物的推断与合成、官能团结构、有机反应方程式书写、限制条件同分异构体的书写等,(3)中同分异构体书写为易错点、难点.


科目:高中化学 来源: 题型:选择题
| A. | 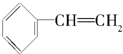 | B. | 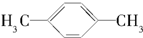 | C. | 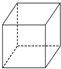 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
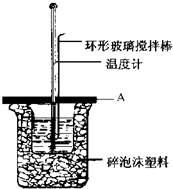 如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是减少热量损失; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响).
如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是减少热量损失; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的负极锌发生还原反应 | |
| B. | 该电池反应中二氧化锰起催化剂作用 | |
| C. | 当0.lmol Zn完全溶解时,流经电解液的电子个数约为1.204×1023 | |
| D. | 电池正极反应式为 MnO2+e-+H20═MnO(OH)+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl•在反应中是催化剂 | |
| B. | Cl•比Cl2更活泼 | |
| C. | ②也可能是Cl•(g)+CH4(g)→CH3Cl(g)+H•(g) | |
| D. | 由③可知C-Cl的键能比Cl-Cl的键能小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| B. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| C. | 漂白粉长期暴露在空气中会变质失效 | |
| D. | 煤炭燃烧过程安装固硫装置,可有效提高煤的利用率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com