
| N2(mol•L-1) | H2(mol•L-1) | NH3(mol•L-1) | |
| 起始时 | 3 | 3 | 0 |
| 2s末 | 2.6 | 1.8 | 0.8 |
分析 (1)图表中2s内氢气浓度变化=3mol/L-1.8mol/L=1.2mol/L,根据反应速率V=$\frac{△c}{△t}$来计算;
(2)根据化学平衡状态的标志可知,正逆反应速率相同、各组分含量保持不变时反应达到平衡,2s末无法判断反应是否达到平衡状态.
解答 解:(1)用H2表示该反应2s内的平均反应速率为,V(H2)=$\frac{△c}{△t}$=$\frac{3mol/L-1.8mol/L}{2s}$=$\frac{1.2mol/L}{2s}$=0.6 mol•L-1•s-1,故答案为:0.6 mol•L-1•s-1;
(2)因无化学平衡状态的标志,所以不能确认该反应2s末已达化学平衡状态,故答案为:不能.
点评 本题主要考查了反应速率的计算,平衡状态判断依据,难度不大,把握平衡的判断方法及表格中数据分析为解答的关键.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| A. | HCN | B. | HF | C. | CH3COOH | D. | HNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入溴水中观察溶液颜色的变化 | B. | 嗅闻它们的气味 | ||
| C. | 比较它们在水中的溶解度大小 | D. | 点燃它们后,观察火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用铁片和稀硫酸反应制氢气时,滴入几滴硫酸铜溶液可以加快反应速率 | |
| B. | 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢 | |
| C. | SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢 | |
| D. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
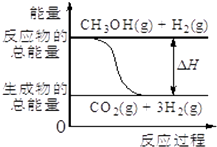 已知CH3OH(g)+H2O(g)=CO2(g)+3H2(g),该反应中的能量变化如图所示下列说法不正确的是( )
已知CH3OH(g)+H2O(g)=CO2(g)+3H2(g),该反应中的能量变化如图所示下列说法不正确的是( )| A. | 该反应拆开反应物所有键所吸收的总能量小于形成生成物所放出的总能量 | |
| B. | 该反应是放热反应 | |
| C. | 该反应不能设计成原电池 | |
| D. | 该反应所有分子中各原子都以共价键相结合? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
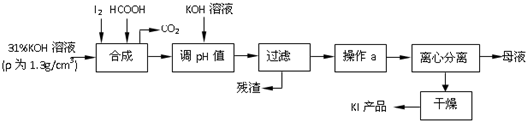
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com