
| A. | 离子半径的大小顺序为:r(R2-)>r(X+)>r(Y2-) | |
| B. | 最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| C. | Y与X形成的化合物和Y与W形成的化合物化学键类型完全相同 | |
| D. | 分别向BaCl2溶液中通入RY2、WY2,均有白色沉淀生成 |
分析 X的原子半径在短周期主旋元素中最大,应为Na元素;Y元素的原子外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,因为L层电子最多为8,则n=2,m=6,所以Y为O元素,Z为Si元素,W元素与Z元素同主族,应为C元素,R元素原子与Y元素原子的核外电子数之比为2:1,Y的核外电子数为8,则R的核外电子数为16,应为S元素,结合元素对应单质、化合物的性质以及元素周期律可解答该题.
解答 解:X的原子半径在短周期主旋元素中最大,应为Na元素;Y元素的原子外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,因为L层电子最多为8,则n=2,m=6,所以Y为O元素,Z为Si元素,W元素与Z元素同主族,应为C元素,R元素原子与Y元素原子的核外电子数之比为2:1,Y的核外电子数为8,则R的核外电子数为16,应为S元素,
A.电子层数越多半径越大,电子层数相同时核电荷数越多半径越小,硫离子三个电子层,钠离子和氧负离子的电子层结构相同,钠的核电荷数多,所以r(R2-)>r(Y2-)>r(X+),故A错误;
B.R是S元素,W是C元素,Z为Si元素,元素的非金属性逐渐减弱,所以最高价氧化物对应水化物的酸性逐渐减弱,故B正确;
C.X与Y形成的两种化合物分别为Na2O、Na2O2,两者都是离子化合物,Y与W形成的化合物CO、CO2,两者都是共价化合物,所以化学键的类型不完全相同,故C错误;
D.SO2、CO2对应的酸的酸性比盐酸弱,与氯化钡都不反应,故D错误.
故选B.
点评 本题考查原子结构和元素周期律的递变规律,题目难度中等,根据原子结构特点正确推断元素的种类为解答该题的关键,注意元素非金属性的比较.


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:解答题
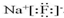 ,化合物类型:离子化合物,化学键类型:离子键.
,化合物类型:离子化合物,化学键类型:离子键.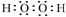 ,化合物类型:共价化合物,化学键类型:共价键.
,化合物类型:共价化合物,化学键类型:共价键.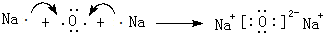 或
或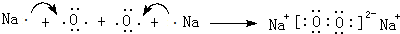 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
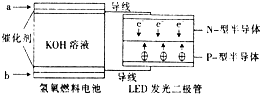 LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )| A. | P-型半导体连接的是电池负极 | |
| B. | b处为电池正极,发生了还原反应 | |
| C. | a处通入氢气,发生还原反应 | |
| D. | 该装置中只涉及两种形式的能量转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
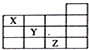
| A. | X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐 | |
| B. | 等物质的量浓度的X、Y、Z的气态氢化物的水溶液的pH:X>Y>Z | |
| C. | Z的单质常温下是液体,可与铁粉反应 | |
| D. | Z的原子序数比Y大9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下都不可用铝制容器贮存 | |
| B. | 常温下都能与铜较快反应 | |
| C. | 露置于空气中,溶液浓度均降低 | |
| D. | 在空气中长期露置,溶液质量均减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 作为相对原子质量标准的原子${\;}_{6}^{14}$C | |
| B. | 氯化镁的电子式: | |
| C. | 用电子式表示氯化氢分子的形成过程: | |
| D. | HClO的结构式为:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子的电子式为: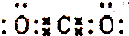 | |
| B. | 质子数为x,中子数为y的氧元素的核素符号为${\;}_{x}^{x+y}$O | |
| C. | Cl-的离子结构示意图为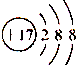 | |
| D. | HClO的结构式为H-Cl-O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com