
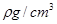 ,NA为阿伏加德罗常数,相邻的两个
,NA为阿伏加德罗常数,相邻的两个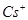 的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为( )
的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为( )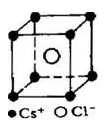
A.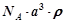 | B.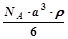 | C.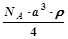 | D.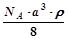 |
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.水被冷却到00C以下时变成冰,是因为水分子从液体变成了固体 |
| B.所有物质在温度变化时都能表现出三态变化 |
| C.不降低温度,只增大压强,也可能使物质从气体变成液体 |
| D.物体能够热胀冷缩是因为构成物体的微粒能够热胀冷缩 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为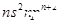 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.有些物质是由分子直接构成的,如二氧化碳、二氧化硅;有些物质是由原子直接构成,如金刚石、晶体硅;有些是由离子直接构成的,如氯化铵 |
| B.分子是保持物质性质的一种微粒,且是化学变化中的最小微粒 |
| C.在水溶液中能电离出自由移动离子的晶体不一定是离子晶体 |
| D.使晶体中化学键断裂的变化一定是化学变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑥ | B.①②④ | C.②④⑥ | D.③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳化铝,黄色晶体,熔点2200℃,熔融态不导电 |
| B.溴化铝,无色晶体,熔点98℃,熔融态不导电 |
| C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中 |
| D.氯化铝,无色晶体,熔融时不能导电 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 请回答:
请回答: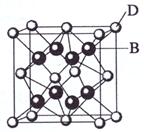
 (1)
(1) A与B形成的化合物在固态时的晶体类型是 ;A与B形成的化合物比A与C形成的化合物熔点要____(填高、低)
A与B形成的化合物在固态时的晶体类型是 ;A与B形成的化合物比A与C形成的化合物熔点要____(填高、低)
 写出C的单质与水反应的离子方程式 ;
写出C的单质与水反应的离子方程式 ;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com