
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)常温下,浓度均为0.1molL﹣1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,结合质子能力最强的是 .
②根据表中数据判断,浓度均为0.01molL﹣1的下列四种物质的溶液中,酸性最强的是;将各溶液分别稀释100倍,pH变化最小的是(填编号).
A.HCN B.HClO C.H2CO3 D.CH3COOH
③据上表数据,请你判断下列反应不能成立的是(填编号).
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为 .
(2)已知常温下Cu(OH)2的Ksp=2×10﹣20 . 又知常温下某CuSO4溶液里c(Cu2+)=0.02molL﹣1 , 如果要生成Cu(OH)2沉淀,则应调整溶液pH大于;要使0.2molL﹣1的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH为 .
【答案】
(1)CO32﹣;D; A; C;2Cl2+CO32﹣+H2O=CO2↑+2Cl﹣+2HClO
(2)5;6
【解析】解:(1)①弱酸根质量水解程度越大,相同浓度的钠盐溶液的pH越大,则酸根离子结合质子能力越大,根据溶液pH知,CO32﹣的水解程度最大,则CO32﹣结合质子能力最强,所以答案是:CO32﹣;
②酸的酸性越强,酸的电离程度越大,其酸根离子水解程度越小,相同浓度的钠盐溶液的pH越小,根据表中数据知,酸性最强的醋酸、酸性最弱的酸是HCN;加水稀释促进弱酸电离,相同浓度的不同酸稀释相同的倍数,酸的酸性越弱,酸的PH变化越小,酸性最弱的酸是HCN,则pH变化最小的是HCN,故选:D;A;
③A.醋酸酸性大于碳酸,所以CH3COOH+Na2CO3=NaHCO3+CH3COONa能发生,故不选;
B.醋酸酸性大于氢氰酸,所以CH3COOH+NaCN=CH3COONa+HCN能发生,故不选;
C.次氯酸酸性小于碳酸而大于碳酸氢根离子,所以CO2+H2O+NaClO=NaHCO3+HClO能发生,故选;
所以答案是:C;
④HClO和碳酸钠不反应,盐酸和碳酸钠反应生成二氧化碳,所以导致氯水中HClO浓度增大,离子方程式为2Cl2+CO32﹣+H2O=CO2↑+2Cl﹣+2HClO,
所以答案是:2Cl2+CO32﹣+H2O=CO2↑+2Cl﹣+2HClO;(2)某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则应有c(OH﹣)≥ ![]() mol/L=10﹣9mol/L,则c(H+)≤
mol/L=10﹣9mol/L,则c(H+)≤ ![]() mol/L=10﹣5mol/L,
mol/L=10﹣5mol/L,
所以pH≥﹣lg(10﹣5)=5;Cu2+沉淀较为完全是的浓度为 ![]() =2×10﹣4mol/L,
=2×10﹣4mol/L,
则c(OH﹣)= ![]() mol/L═10﹣8mol/L,
mol/L═10﹣8mol/L,
则c(H+)= ![]() mol/L=10﹣6mol/L,
mol/L=10﹣6mol/L,
所以pH=﹣lg(10﹣6)=6,
所以答案是:5;6.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知: ![]()
![]()
![]() ,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:
,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径: 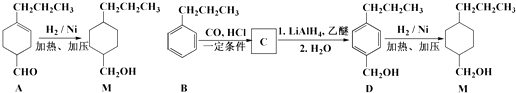
(1)常温下,下列物质能与A发生反应的有(填序号). a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)由A催化加氢生成M的过程中,可能有中间生成物 ![]() 和(写结构简式)生成.
和(写结构简式)生成.
(3)检验D中是否含有C可选用的试剂是(任写一种名称).
(4)物质D也可由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为 .
(5)C的一种同分异构体E具有如下特点: a.分子中含﹣OCH2CH3 b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马拉松长跑运动员在进入冲刺阶段时,发现少数运动员下肢肌肉发生抽搐,这是由于随着大量排汗而向外排出了过量的
A. 水 B. 钙盐 C. 钠盐 D. 尿素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCH4和适量的O2在密闭容器中点燃,充分反应后,CH4和O2均无剩余,且产物均为气体(101kPa,120℃ ),总质量为72g,下列有关叙述不正确的是
A. 若将产物通过碱石灰,则不能被完全吸收
B. 若将产物通过浓硫酸,充分吸收后,浓硫酸增重18g
C. 产物的平均摩尔质量为24g.mol-1
D. 反应中消耗O256g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学式为C2H6O的化合物A具有如下性质:
A+Na→慢慢产生气泡
A+CH3COOH![]() 有香味的产物
有香味的产物
(1)根据上述信息,对该化合物可作出的判断是 ______ .
A.一定含有-OH B.一定含有-COOH C.A为乙醇 D.A为乙醛
(2)含A的体积分数为75%的水溶液可以用作 ______ .
(3)A与钠反应的化学方程式: ________________________________________ .
(4)化合物A与CH3COOH反应生成的有香味的产物的结构简式为:________________ .
(5)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式:___________________.
(6)如图是B分子的球棍模型和A分子的比例模型,若A和B的关系是同系物,则B的结构简式 ______ .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按分子结构决定性质的观点可推断  有如下性质:
有如下性质:
(1)苯环部分可发生反应和反应.
(2)﹣CH═CH2部分可发生反应和反应.
(3)该有机物滴入溴水后生成产物的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤不仅是重要的能源,也是化学工业的重要原料。下图为以煤为原料合成TNT和高聚物F的路线。
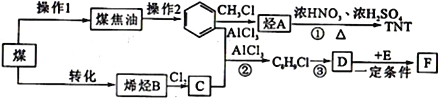
请回答下列问题:
(1)下列说法正确的是_______。
A.操作1是煤的干馏
B.煤的气化是化学变化,煤的液化是物理变化
C.煤中含有苯和二甲苯,所以煤干馏可得到苯和二甲苯
(2)由![]() 生成烃A的反应类型是_______________,TNT的核磁共振氢谱有________组峰。
生成烃A的反应类型是_______________,TNT的核磁共振氢谱有________组峰。
(3)C的结构简式是________________。
(4)含有苯环的有机物分子式为C8H9Cl,苯环上有3个取代基的同分异构体的数目为________种。
(5)E是1,3-丁二烯,F是高分子化合物,D与E反应的方程式是_____________________________。
(6)请写出以乙酸和![]() 为原料制备化工产品
为原料制备化工产品![]() 的合成路线_____________________________________________。
的合成路线_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有100个氨基酸共含有116个羧基和106个氨基,这些氨基酸缩合成6条多肽链时共含有—NH2个数是( )
A. 6 B. 12 C. 22 D. 100
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com