
【题目】某小组进行测定某变质的铁铝合金(杂质主要为Al2O3和Fe2O3)样品中铁含量,并制备Fe3O4胶体粒子,相关实验方案设计如下:

已知:乙醚[(C2H5)2O]易燃,沸点为34.5度,微溶于水,密度比水小。在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚;当盐酸浓度降低时,该化合物解离。
请回答下列问题:
(1)溶液II中主要金属阳离子是__________________。
(2)步骤I中试剂A最佳选择的是_____________。
A.浓硝酸 B.浓硫酸 C.浓盐酸+双氧水 D.稀盐酸+双氧水
(3)步骤II的“一系列操作”包括如下实验步骤,选出其正确操作并按序列出字母:分液漏斗中加水检验是否漏水→向溶液中加入适量浓盐酸和乙醚,转移至分液漏抖→(__________)→(_________)→(__________)→(__________)→f→(_________)→a→(__________)→d→(_________)。
a.左手拇指和食指旋开旋塞放气;
b.用右手压住玻璃塞,左手握住旋塞,将分液漏斗倒转,并用力振摇;
c.静置分层;
d.打开上口玻璃塞,将下层液体从下口放出,上层液体从上口倒出;
e.混合两次分液后的上层液体;
f.向下层液体中加入浓盐酸和乙醚并转移至分液漏斗;
(4)下列关于步骤Ⅲ和步骤VI的涉及的操作说法正确的是_______________。
A.步骤Ⅲ中蒸馏操作时,为加快蒸馏速度,采用酒精灯大火加热,收集34.5℃的馏分
B.为减少乙醚挥发,在蒸馏操作时,收集乙醚的锥形瓶应放置在冰水浴中
C.步骤VI由混合溶液制得Fe3O4胶体粒子的过程中,须持续通入N2,防止Fe2+被氧化
D.析出Fe3O4胶体粒子后通过抽滤,洗涤,干燥获得Fe3O4胶体粒子
(5)步骤IV测定Fe3+方法有多种,如转化为Fe2O3,间接碘量滴定,分光光度法等。
①步骤IV主要作用是测定样品中的铁总含量和______________________。
②步骤IV实验时采用间接碘量法测定Fe3+含量,具体过程如下:向25.00mL溶液中加入过量KI溶液,充分反应后,滴入几滴淀粉作指示剂,用0.1000mol·L-1Na2S2O3标准溶液进行滴定,到达滴定终点时,消耗Na2S2O3标准溶液体积为VmL。已知滴定反应为:I2+2Na2S2O3=2NaI+Na2S4O6。不考虑Fe3+和I-反应限度和滴定操作问题,实际测定的Fe含量往往偏高,其主要原因是________________________________________。
【答案】Al3+ C b a c d b c e BC 控制步骤V中加入还原剂的用量 空气中的氧气(溶液中的溶解氧)将I-氧化为I2
【解析】
样品溶于有氧化性的试剂A得到Fe3+和Al3+,“一系列操作”为乙醚将Fe3+萃取到有机层,通过“一系列操作”将含Fe3+的有机层和Al3+分离,溶液Ⅱ含大量Al3+,溶液Ⅰ加水、蒸馏得到Fe3+溶液,通过步骤Ⅳ测定Fe3+含量,通过步骤Ⅴ还原部分Fe3+,加NaOH溶液得到Fe(OH)3和Fe(OH)2的混合物,加热得到Fe3O4胶粒。
(1)由流程可知,溶液Ⅱ的金属离子主要是Al3+,故答案为:Al3+;
(2)试剂A将亚铁氧化成Fe3+,浓硫酸和浓硝酸的还原产物有毒,污染环境,最好不用,可选双氧水作氧化剂。由“已知”可知:步骤Ⅱ中需浓HCl才能萃取Fe3+,因此步骤Ⅰ最好加浓HCl,综上所述,试剂A最好为浓盐酸和双氧水的混合物,故答案为:C;
(3)步骤Ⅱ为萃取Fe3+,具体步骤为:分液漏斗中加水检验是否漏水→向溶液中加入适量浓盐酸和乙醚,转移至分液漏抖→用右手压住玻璃塞,左手握住旋塞,将分液漏斗倒转,并用力振摇右→左手拇指和食指旋开旋塞放气→静置分层→打开上口玻璃塞,将下层液体从下口放出,上层液体从上口倒出。为提高Fe3+的萃取率,下层液体重复上面的操作,最后将两次上层液混合即为溶液Ⅰ,第二次萃取的下层液即为溶液Ⅱ,故答案为:b;a;c;d;b;c;e;
(4) A.步骤Ⅲ通过加水后,混合体系为FeCl3、HCl、乙醚的混合物,温度太高,HCl快速挥发,促进了Fe3+水解,影响步骤Ⅳ测量,A错误;
B.乙醚沸点34.5℃,易挥发,为减少乙醚挥发,在蒸馏操作时,收集乙醚的锥形瓶应放置在冰水浴中,B正确;
C.Fe2+有较强还原性,加热过程可被氧气快速氧化,为了防止Fe2+被氧化,可持续通入保护气N2,C正确;
D.胶粒能透过滤纸,不可能用抽滤,应用渗析、干燥等方法获得胶粒,D错误;
综上所述,BC正确,故答案为:BC;
(5)①在步骤Ⅴ中,只有知道样品中铁总含量,才能控制还原剂加多少为合适,即步骤IV主要作用是测定样品中的铁总含量和控制步骤V中加入还原剂的用量,故答案为:控制步骤V中加入还原剂的用量;
②根据电子守恒可得出:2Fe3+~I2~2Na2S2O3,Fe含量偏高,说明I2多了,可能是空气中氧气或溶液中的溶解氧将部分I-氧化成I2所致,故答案为:空气中的氧气(溶液中的溶解氧)将I-氧化为I2。


科目:高中化学 来源: 题型:
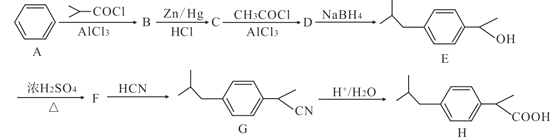
【题目】化合物H是一种医药中间体,其合成路线如图:
已知:
①![]()
![]()
![]()
②![]()
![]()
![]()
(1)B中所含官能团的名称是______,H的最简单同系物名称为______。
(2)B→C的反应类型是______。
(3)F的结构简式为______。
(4)C→D的化学方程式为______。
(5)芳香族化合物X是H的同分异构体,X能发生银镜反应,其核磁共振氢谱显示有5组峰,且峰面积比为12:2:2:1:1,符合要求的X的结构简式为______。
(6)已知RCOOH+SOCl→RCOCl,写出以苯和丙烯酸(CH2=CHCOOH)为原料制备![]() 的合成路线(无机试剂任选):______。
的合成路线(无机试剂任选):______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,三个容积相同的烧瓶内分别充满了干燥的NH3、HCl、NO2气体,然后分别用水作喷泉实验,假设烧瓶内的溶质不散逸,则三种溶液的物质的量浓度之比为 ( )
A. 无法比较B. 2∶2∶3C. 3∶3∶ 2D. 1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极,下列叙述错误的是( )
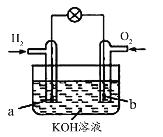
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH――4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.溶液中OH-向正极移动,K+、H+向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
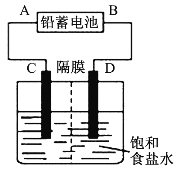
铅蓄电池充、放电时的电池反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
(1)铅蓄电池放电时的正极反应为___。
(2)请写出电解饱和食盐水的化学方程式:____。
(3)若在电解池C极一侧滴入几滴酚酞溶液,电解一段时间后溶液变红色,说明铅蓄电池的A极为___极。
(4)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1.15g·cm-3)时,
①若收集到11.2L(标准状况下)氯气,则至少转移电子____mol。
②若铅蓄电池消耗2molH2SO4,则可收集到H2的体积(标准状况下)为___L。
③若蓄电池消耗amol硫酸,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气和氢气全部排出)___(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙酸和乙醇在浓硫酸作用下制取乙酸乙酯的装置如图。下列说法正确的是
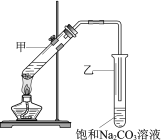
A. 向甲试管中先加浓硫酸,再加乙醇和乙酸
B. 乙试管中导管不伸入液面下,是为了防止倒吸
C. 加入过量乙酸,可使乙醇完全转化为乙酸乙酯
D. 实验完毕,可将乙酸乙酯从混合物中过滤出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。下列叙述错误的是

A. 冰表面第一层中,HCl以分子形式存在
B. 冰表面第二层中,H+浓度为5×103 mol·L1(设冰的密度为0.9 g·cm3)
C. 冰表面第三层中,冰的氢键网格结构保持不变
D. 冰表面各层之间,均存在可逆反应HCl![]() H++Cl
H++Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
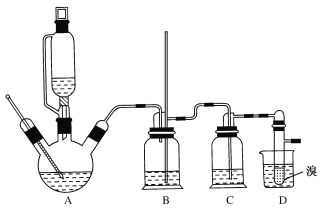
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是___。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是____。
(3)在装置C中应加入NaOH溶液,其目的是____。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法是___。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层(填“上”或“下”)。若产物中有少量未反应的Br2,最好用___洗涤除去;若产物中有少量副产物乙醚,可用____(填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是___。
(7)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在指定的环境中一定能大量共存的是( )
A.某无色酸性溶液中:NH![]() 、Ca2+、F-、Cl-
、Ca2+、F-、Cl-
B.与金属铝反应只放出氢气的溶液:K+、NH![]() 、NO
、NO![]() 、Cl-
、Cl-
C.能使淀粉碘化钾试纸变蓝的溶液中:Na+、NH![]() 、S2-、Br-
、S2-、Br-
D.滴加酚酞试液变红色的溶液:K+、Na+、S2-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com