


 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:
 橡皮筋在拉伸和收缩状态时结构如图,在其拉伸过程中有放热现象,反之吸热.25℃、101kPa时,下列化学反应的焓变、熵变和自发性与橡皮筋从拉伸状态到收缩状态一致的是( )
橡皮筋在拉伸和收缩状态时结构如图,在其拉伸过程中有放热现象,反之吸热.25℃、101kPa时,下列化学反应的焓变、熵变和自发性与橡皮筋从拉伸状态到收缩状态一致的是( )| A、Ba(OH)2?8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O |
| B、2H2+O2=2H2O |
| C、CaCO3=CaO+CO2↑ |
| D、2Na2O2+2H2O=4NaOH+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2溶液中加入少量氨水:Cu2++2OH-═Cu(OH)2↓ |
| B、向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-=2MnO2↓+3SO42-+2H2O |
| C、小苏打溶液中加足量澄清石灰水:HCO3?+Ca2++OH-═CaCO3↓+H2O |
| D、铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、..向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO
| ||
| B、.检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生气体 | ||
| C、.焰色反应试验中,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色 | ||
| D、用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作与现象 | 实验结论 | 判断理由 | |
| 步骤一 | 加入过量NaOH溶液,得到蓝色沉淀; | 肯定有Cu2+、肯定无 | 肯定无该离子的理由 |
| 步骤二 | 将蓝色沉淀过滤、洗涤、灼烧得到24.0g固体; | Cu2+物质的量浓度为 | Cu元素守恒 |
| 步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,得到46.6g不溶于稀硝酸的沉淀. | 肯定有Cl-、 | 肯定有Cl-的理由 |
查看答案和解析>>
科目:高中化学 来源: 题型:
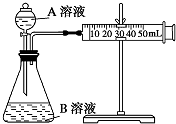 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.| 序号 | T (K) | 催化剂用量(g) | A溶液 | B溶液 |
| ① | 298 | 0 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.001mol/L KMnO4溶液 |
| ② | 298 | 0 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ③ | 323 | 0.5 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ④ | 298 | 0.5 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| 实验序号 | 溶液褪色所需时间t(min) | ||
| 第一次 | 第二次 | 第三次 | |
| ① | 6 | 7 | 7 |
| ② | 14 | 11 | 13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
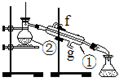
 如图是一套检验气体性质的实验装置示意图.如图所示,向装置中缓慢通入气体X,若关闭活塞K,则试管中的品红试液无变化,而烧杯中的石灰水变浑浊;若打开活塞K,则品红试液褪色.根据此现象判断,气体X和洗气瓶内液体Y可能是( )
如图是一套检验气体性质的实验装置示意图.如图所示,向装置中缓慢通入气体X,若关闭活塞K,则试管中的品红试液无变化,而烧杯中的石灰水变浑浊;若打开活塞K,则品红试液褪色.根据此现象判断,气体X和洗气瓶内液体Y可能是( )| A、③和④ | B、②和④ |
| C、①和② | D、②和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com