
在恒容条件下化学反应:2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
ΔH=-Q kJ·mol-1在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ·mol-1) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是( )
A.在上述条件下反应生成1 mol SO3固体放热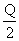 kJ
kJ
B.2Q3<2Q2=Q1<Q
C.Q1=2Q2=2Q3=Q
D.2Q2=2Q3<Q1<Q
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
在硫酸铝、硫酸钾和明矾[KAl(SO4)2•12H2O]的混合溶液中,SO42﹣的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解.则反应后溶液中K+的浓度约为( )
|
| A. | 0.225mol/L | B. | 0.25mol/L | C. | 0.45mol/L | D. | 0.9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸与高锰酸钾在酸性条件下能够发生如下反应:
 +H2C2O4+H+——Mn2++CO2↑+H2O(未配平)
+H2C2O4+H+——Mn2++CO2↑+H2O(未配平)
用4 mL 0.001 mol·L-1 KMnO4溶液与2 mL
0.01 mol·L-1 H2C2O4溶液研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为________。
(2)如果研究催化剂对化学反应速率的影响,使用实验________和________(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验________和________。
(3)对比实验Ⅰ和Ⅳ,可以研究____________________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D为为中学常见单质。通常状况下,A为固体,B为黄绿色气体,C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体。它们之间转化关系如下图所示(其中某些反应条件和部分反应物已略去)。
请回答下列问题:
写出下列物质的化学式:A______、X______。
在反应;① ~⑦中,属于氧化还原反应的有____个;反应⑥说明D溶液中含有___离子。
反应④的离子方程式是__________。
反应⑦的化学方程式是__________。
检验D的溶液中是否含有G离子的方法是_________。
除去D溶液中混有的少量G的方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)====CO2(g) ΔH1<0
途径Ⅱ 先制水煤气:
C(s)+H2O(g)====CO(g)+H2(g) ΔH2>0
再燃烧水煤气:
2CO(g)+O2(g)====2CO2(g) ΔH3<0
2H2(g)+O2(g)====2H2O(g) ΔH4<0
请回答下列问题:
(1)判断两种途径放热:途径Ⅰ放出的热量______途径Ⅱ放出的热量(填“大于”“等于”或“小于”)。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系是________________________。
(3)由于制取水煤气的反应里,反应物具有的总能量_______(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要_______能量才能转化为生成物,因此其反应条件为_________________。
(4)已知:Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)
ΔH1=-25 kJ·mol-1①
3Fe2O3(s)+CO(g)====2Fe3O4(s)+CO2(g)
ΔH2=-47 kJ·mol-1②
Fe3O4(s)+CO(g)====3FeO(s)+CO2(g)
ΔH3=+19 kJ·mol-1③
请写出CO还原FeO的热化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
(1)③、④、⑦的原子半径由大到小的顺序为 (用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 (用酸的化学式表示)。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 ;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
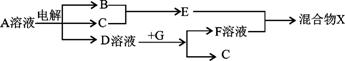
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法 。
③常温下,若电解1L0.1 mol·L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 。
④写出过量的E与F溶液中溶质反应的离子方程式 。
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.化学反应中的能量变化,都表示为热量的变化
B.需要加热才能发生的化学反应,一定是吸热反应
C.放热反应在常温下一定很容易发生
D.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
查看答案和解析>>
科目:高中化学 来源: 题型:
电解84.75 mL 16%的NaOH溶液(ρ=1.18 g·cm-3),用石墨作电极经过一段时间后溶液浓度为19.5%,这是因为( )
A.溶质增加了3.5 g
B.放出了22.4 L H2和11.2 L O2
C.NaOH比水消耗少
D.消耗18 g水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com