
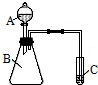
| A. | 蒸馏实验时向蒸馏烧瓶中放入几粒沸石(或碎瓷片) | |
| B. | 金属钠着火时使用泡沫灭火器灭火 | |
| C. | 用试管加热碳酸氢钠固体时使试管口略向上倾斜 | |
| D. | 浓硫酸溅到皮肤上立即用稀氢氧化钠溶液冲洗 |
分析 A.加入碎瓷片,防止暴沸;
B.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应;
C.碳酸氢钠分解生成水;
D.酸碱中和放出大量的热,且强酸、强碱具有强腐蚀性.
解答 解:A.蒸馏实验时加入碎瓷片,防止暴沸,从实验安全的角度考虑,故A正确;
B.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应,反应生成的氧气助燃,不能灭火,应利用沙土铺盖,故B错误;
C.碳酸氢钠分解生成水,则用试管加热碳酸氢钠固体时使试管口略向下倾斜,故C错误;
D.酸碱中和放出大量的热,且强酸、强碱具有强腐蚀性,则浓硫酸溅到皮肤上时立即用抹布擦拭,再水冲洗,最后涂上适量的碳酸氢钠溶液,故D错误;
故选A.
点评 本题考查化学实验安全及事故处理,侧重化学与生活、实验安全的考查,把握物质的性质、实验基本技能、实验安全常识等为解答的关键,题目难度不大.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||||
| Y | Z | W |
| A. | X分别与Y、Z形成的化合物中化学键类型相同 | |
| B. | Z的最高价氧化物的对应水化物酸性比W的强 | |
| C. | X的简单气态氢化物的稳定性比W的弱 | |
| D. | Y是第三周期第ⅡA族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表中实线表示目前元素周期表七个周期的部分边界. ①~⑧八种元素在周期表中的相对位置如下:
下表中实线表示目前元素周期表七个周期的部分边界. ①~⑧八种元素在周期表中的相对位置如下:
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | W | |
| T |
| A. | 化合物YX2、ZX2化学键类型和晶体类型均相同 | |
| B. | Z、W、T三种元素最高价氧化物的水化物的酸性依次增强 | |
| C. | 五种元素中,只有T是金属元素 | |
| D. | Mg在一定条件下可以和YX2发生反应生成Y单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com