
分析 有机物的物质的量为$\frac{1.89g}{94.5g/mol}$=0.02mol,产生的气体依次通过浓硫酸和NaOH溶液,后者增重2.64g,为CO2的质量,且n(CO2)=$\frac{2.64}{44g/mol}$=0.06mol,则有机物含有3个C原子,用钠熔法测定含氯元素,经红外光谱分析有C-O、O-H等化学键,且存在手性碳原子,说明含有-OH,且含有Cl,分子式应为C3H7OCl,以此解答该题.
解答 解:有机物的物质的量为$\frac{1.89g}{94.5g/mol}$=0.02mol,产生的气体依次通过浓硫酸和NaOH溶液,后者增重2.64g,为CO2的质量,且n(CO2)=$\frac{2.64}{44g/mol}$=0.06mol,则有机物含有3个C原子,用钠熔法测定含氯元素,经红外光谱分析有C-O、O-H等化学键,且存在手性碳原子,说明含有-OH,且含有Cl,分子式应为C3H7OCl,则结构简式应为CH3CHClCH2OH,
答:该有机物的结构简式为CH3CHClCH2OH.
点评 本题考查有机物的推断,侧重考有机物分子式计算以及结构的判断,题目难度中等,试题培养了学生的分析、理解能力及化学计算能力.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:多选题
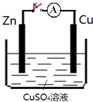
| A. | K打开,Zn片上会有金属铜析出 | |
| B. | 无论K是否闭合,锌片均会溶解,溶液均从蓝色逐渐变浅 | |
| C. | K闭合时,SO42-向铜电极移动 | |
| D. | K闭合时,电子从负极Zn流向正极 Cu,再从溶液中回到负极Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | 由金属A和金属B构成的原电池,电子由A流向B | |
| C. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| D. | 常温时,A能从酸中置换出氢,而B不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2分子结构式:H-O-O-H | B. | 氚原子符号:${\;}_{1}^{2}$H | ||
| C. | Mg2+结构示意图: | D. | CO2的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在干旱地区植树造林时,可利用高吸水性树脂抗旱保水 | |
| B. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶的原料 | |
| C. | SiO2的导电能力强,可用于制造太阳能电池板 | |
| D. | 服用阿司匹林若出现水杨酸反应,应立即停药并静脉滴注NaHCO3溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
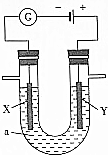 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:填空题
【选做题——物质结构与性质】
早期发现的一种天然二十面体准晶颗粒由 Al、Cu、Fe 三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___________方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有个___________个未成对电子。Fe3+的电子排布式为_____________ 。
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为__________,1 mol乙醛分子中含有的σ键的数目为______________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有___________个铜原子。锗也是一种半导体材料,Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键,从原子结构角度分析,原因是_______________________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图

镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=_____________(填数值);氢在合金中的密度为_____________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,共转移NA个电子
B.标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA
C.标准状况下,11.2 L HF含有0.5 NA个HF分子
D.500mL 12mol.L-1的盐酸与足量 MnO2加热充分反应,生成Cl2 分子数目1.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com