
 某实验小组依据反应 AsO43-+2H++2I-?AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得电压与pH的关系如图.下列有关叙述错误的是( )
某实验小组依据反应 AsO43-+2H++2I-?AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得电压与pH的关系如图.下列有关叙述错误的是( )| A. | pH=0.68时,反应处于平衡状态 | |
| B. | 调节pH可以改变反应的方向 | |
| C. | pH>0.68时,负极电极反应式为2I--2e -═I2 | |
| D. | pH=5时,氧化性I2>AsO43- |
分析 A.pH=0.68时,电压为0,反应处于平衡状态;
B.pH>0.68时,电压小于0,反应向左进行,pH<0.68时,电压大于0,反应向右进行;
C.pH>0.68时,电压小于0,反应逆向进行,负极反应为AsO33-失电子;
D.pH=5时,电压小于0,反应逆向进行,氧化性I2>AsO43-.
解答 解:A.pH=0.68时,电压为0,反应处于平衡状态,故A正确;
B.pH>0.68时,电压小于0,反应向左进行,pH<0.68时,电压大于0,反应向右进行,则调节pH可以改变反应的方向,故B正确;
C.pH>0.68时,电压小于0,反应逆向进行,则负极电极反应式为:AsO33--2e-+H2O=AsO43-+2H+,故C错误;
D.pH=5时,电压小于0,反应逆向进行,I2为氧化剂,AsO43-为氧化产物,则氧化性I2>AsO43-,故D正确.
故选:C.
点评 本题考查了原电池原理的应用和化学平衡移动,侧重于知识的综合应用的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H2O>H2Te>H2Se>H2S | B. | HF>HI>HBr>HCl | ||
| C. | SbH3>NH3>AsH3>PH3 | D. | H2O>NH3>HF>CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 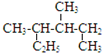 的系统命名是2,3-二甲基戊烷 的系统命名是2,3-二甲基戊烷 | |
| B. | 向鸡蛋清溶液中分别加入(NH4)2SO4和CuSO4溶液都能使鸡蛋清聚沉,其作用原理相同 | |
| C. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与足量的氢气充分反应后的产物也不是同系物 | |
| D. | 等物质的量的乙炔、乙醛、(HO)CH2-CH2(OH)完全燃烧时的耗氧量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种名贵的香料,又是合成VE、VA、紫罗兰酮、胡萝卜素等的中间体.合成芳樟醇的一种方法如下:
)是一种名贵的香料,又是合成VE、VA、紫罗兰酮、胡萝卜素等的中间体.合成芳樟醇的一种方法如下:
 ,C分子中的官能团名称为羰基、碳碳双键,已知反应I和反应Ⅱ的原子利用率100%,则A的结构简式为HC≡CH.
,C分子中的官能团名称为羰基、碳碳双键,已知反应I和反应Ⅱ的原子利用率100%,则A的结构简式为HC≡CH.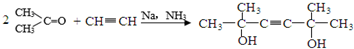 .
.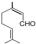 ,写出柠檬醛的另一种同分异构体的结构简式(不改变分子中原子的连接方式)
,写出柠檬醛的另一种同分异构体的结构简式(不改变分子中原子的连接方式)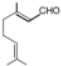 ;芳樟醇在H+作用下也可异构化为香叶醇(
;芳樟醇在H+作用下也可异构化为香叶醇(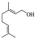 ).下列有关柠檬醛的下列说法正确的是BCD
).下列有关柠檬醛的下列说法正确的是BCD查看答案和解析>>
科目:高中化学 来源: 题型:解答题
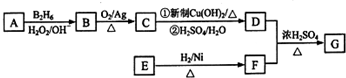
 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
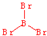 ;三溴化磷
;三溴化磷 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.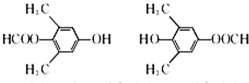 .
.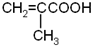 )的合成路线:
)的合成路线: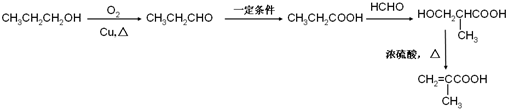 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3BH3中H元素均为+1价 | |
| B. | 合成反应中每生成1 mol NH3BH3会转移2 mol e- | |
| C. | 两个反应中,H2均既是氧化产物,又是还原产物 | |
| D. | 0.1 mol NH3BH3发生上述催化脱氢反应,一定生成6.72 L H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com