
【题目】硫酸是当今世界最重要的化工产品之一。
I.硫酸的各种制法。
(1)早在1000多年前,我国就已采用加热胆矾(CuSO4· 5H2O)或绿矾(FeSO4·7H2O)的方法制取硫酸。FeSO4受热分解的化学方程式:2 FeSO4![]() Fe2O3+SO2↑ +SO3↑。
Fe2O3+SO2↑ +SO3↑。
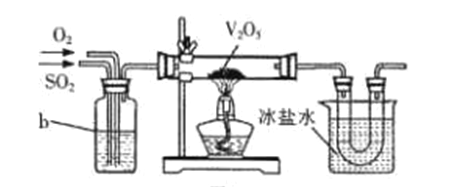
① 将FeSO4受热产生的气体通入如下图装置中,以检验产生的气体中是否含有SO3和SO2。 能说明SO2存在的实验现象是_________。

② 有同学提出虚线框内盛装NaOH溶液的装置可以换成上图右边的a装置,其中多孔玻璃球泡的作用是__________。
(2)目前工业上主要采用接触法制备硫酸,其中一步为:2SO2+O2![]() 2SO3。实验室模拟该过程常用下图装置进行实验。b装置中装有浓硫酸,写出b装置的作用__________(写出两点)。
2SO3。实验室模拟该过程常用下图装置进行实验。b装置中装有浓硫酸,写出b装置的作用__________(写出两点)。
Ⅱ.硫酸的性质。
(3)下图中甲试管内发生反应的化学方程式_________ ,该反应体现了浓硫酸的性质为______。
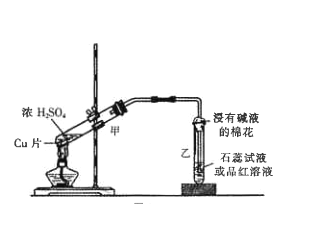
(4)当铜片与浓硫酸充分反应后,试管内并未出现蓝色溶液,而是看到白色固体,请写出检验白色固体的方法______________。
【答案】 品红溶液褪色 增大接触面,提高气体的吸收效率 干燥气体;使气体均匀混合;控制气流速度,调整气流比例 Cu+2H2SO4(浓) ![]() CuSO4+SO2↑ +2H2O 酸性和氧化性 取少量白色固体溶于水,观察到溶液呈蓝色,证明有Cu2+;再滴加适量硝酸酸化的硝酸钡溶液,有白色沉淀生成,证明有SO42-。综上说明该白色固体为CuSO4
CuSO4+SO2↑ +2H2O 酸性和氧化性 取少量白色固体溶于水,观察到溶液呈蓝色,证明有Cu2+;再滴加适量硝酸酸化的硝酸钡溶液,有白色沉淀生成,证明有SO42-。综上说明该白色固体为CuSO4
【解析】(1)①SO2具有漂白性,能使品红褪色,故能说明SO2存在的实验现象是试剂瓶中的品红溶液褪色;②多孔玻璃球泡可以增大SO2气体与NaOH溶液的接触面,提高气体的吸收效率。
(2)混合气体通过b装置,b装置的作用有三个:干燥气体、使气体均匀混合、控制气流速度,调整气流比例。
(3)加热下,Cu能与浓硫酸反应,化学方程式为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑ +2H2O;体现了浓硫酸的强氧化性和酸性。
CuSO4+SO2↑ +2H2O;体现了浓硫酸的强氧化性和酸性。
(4)浓硫酸中水的含量很少,生成的硫酸铜未溶解,以固体形式存在,故只看到白色固体,要检验白色固体的成分,可以取少量白色固体溶于水,观察到溶液呈蓝色,证明有Cu2+;再滴加适量硝酸酸化的硝酸钡溶液,有白色沉淀生成,证明有SO42-。综上说明该白色固体为CuSO4。


科目:高中化学 来源: 题型:
【题目】在80℃时,将0.40mol的N204气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O42NO2 , 隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s一40s内用N2O4表示的平均反应速率为molL﹣1S﹣1;
(2)计算在80℃时该反应的平衡常数K=(请注明单位).
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”.“变深”或“不变”)
(4)要增大该反应的K值,可采取的措施有(填序号):
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线. 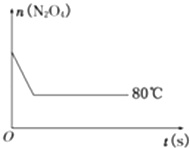
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中的现象及结论均正确的是

A. 锥形瓶中有气体产生,烧杯中液体变浑浊,证明非金属性:Cl>C>Si
B. 形成美丽的红色喷泉,证明HC1极易溶于水
C. 配制一定物质的量浓度的NaOH溶液时,定容时如图观察使配制的NaOH 溶液浓度偏低
D. 只产生红褐色沉定,证明Ksp[Al(OH3)]>Ksp[Fe(OH)3]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL FeI2溶液中逐渐通入C12,其中n(I2)、n(Fe3+)随通入n(C12)的变化如图所示,下列说法不正确的是

A. 氧化性强弱:I2<Fe3+
B. n(Cl2)=0.12mol时,溶液中的离子主要有Fe2+、Fe3+、Clˉ
C. 由图可知,该FeI2溶液的浓度为1mol· L-l
D. n(C12):n(FeI2)=1:2时,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理饮食和正确用药,是人体健康的重要保证. 现有下列五种物质 A.新鲜的橙汁 B.葡萄糖 C.食盐 D.小苏打 E.青霉素,
请按下列要求填空(填序号).
应用最广泛的抗生素之一的是 , 可直接进入血液,补充能量的是 , 既可作为疏松剂,又可治疗胃酸过多的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铜是人们最早使用的金属之一,下列关于铜电极的叙述不正确的是( )
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时粗铜做阳极
C.在镀件上镀铜时可用金属铜做阳极
D.电解水制H2、O2时铜做阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列说法正确的是( )
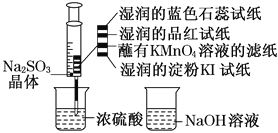
A. 蓝色石蕊试纸先变红后褪色
B. 品红试纸、蘸有KMnO4溶液的滤纸均褪色能证明SO2的漂白性
C. 湿润的淀粉KI试纸未变蓝说明SO2的氧化性强于I2
D. NaOH溶液可用于除去实验中多余的SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的核外电子排布式为______;基态D原子核外电子占据的能量最高的能级符号为_____________。
(2)A元素的各级电离能如下:
能级(I) | I1 | I2 | I3 | I4 | I5 |
电离能/kJ·mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
分析上表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是__________。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是________。
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是_______(填分子式)。
(5)(DC)4为热色性固体,且有色温效应。低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。在淡黄色→橙黄色→深红色的转化中,破坏的作用力是____;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_______。在B、C、D的简单气态氢化物中,属于非极性分子的是______(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是_______________。
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示。已知:该晶体密度为ρg·㎝-3,NA代表阿伏伽德罗常数的值。

①该晶体的化学式为__________。
②在该晶体中,A与C形成共价键的键长(d)为_____pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com