
I.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为 ,其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”),冰晶石的作用为 。
(2)铝电池性能优越,A1-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH=2NaAl02+6Ag+H20,则负极的电极反应式为 ,正极附近溶液的pH (填“变大”“不变”或“变小”)。
已知: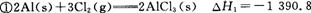 kJ/mol
kJ/mol
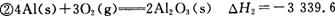 kJ/mol
kJ/mol
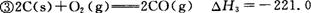 kJ/mol
kJ/mol
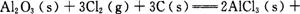
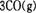 的ΔAH= 。
的ΔAH= 。
 Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
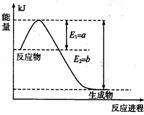
(1)右图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中的能量变化示意图,请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为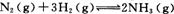 在一定温度下,将一定量的N2和H2通入到体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
在一定温度下,将一定量的N2和H2通入到体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
A.增大压强 B.增大反应物的浓度 C.使用催化剂 D.降低温度
Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为 ,有3 m01FeS2参加反应,转移 mol电子。
,有3 m01FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
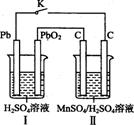 Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnS04溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示,铅蓄电池的总反应方程式为 ,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。
Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnS04溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示,铅蓄电池的总反应方程式为 ,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为
A.3∶2∶1 B.2∶4∶1 C.2∶3∶1 D.4∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
21世纪新材料是高新技术的突破口,只有更好地开发和应用具有特殊性能的新材料,才能拥有更强大的经济实力和技术潜力。下列各学科,对于新材料的开发和研制最具有独特优势的是( )
A.物理 B.化学 C.地理 D.生物
查看答案和解析>>
科目:高中化学 来源: 题型:
H2SO4和HNO3的浓度分别为4mol/L和2mol/L的混合液,取10mL加入过量的铁粉,若HNO3的还原产物为NO,则生成气体在标况下的总体积为 ( )
A.0.224L B.0.672L C.0.112L D.0.336L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.石墨比金刚石稳定,故石墨转化为金刚石的反应可以自发进行
B.吸热反应能自发进行的原因是从外界获得了能量
C.Si02常温下可以与NaOH溶液和HF溶液反应,说明其具有两性
D.反应A(g)+B(g)=2C(s)可以自发进行,则其必为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
分类是化学研究中常用的方法。下列分类方法中,不正确的是
①根据元素原子最外层电子数的多少将元素分为金属和非金属
②根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质
③依据组成元素的种类,将纯净物分为单质和化合物
④根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等
⑤根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物
⑥根据分散系的稳定性大小,将分散系分为胶体、浊液和溶液
A.只有①③ B.③④⑤⑥ C.①④⑤⑥ D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数的数值,下列说法正确的是
A. 1mol FeCl3完全水解生成NA个胶体粒子
B. 常温常压下,23g NO2分子总数小于0.5NA
C. 标准状况下,2.24 L的CCl4中含有的C—Cl键数为0.4NA
D. 6.8g熔融态KHSO4中含有0.1NA个阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
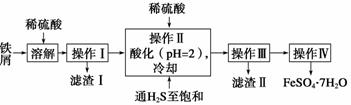
查询资料,得有关物质的数据如下表:
| 25 ℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(1)操作Ⅱ中,通入硫化氢至饱和的目的是____________;在溶液中用硫酸酸化至pH=2的目的是_______________________________________________________。
(2)操作Ⅳ的顺序依次为蒸发浓缩、冷却结晶、___________________________。
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②________________________________________________________。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850 g绿矾产品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①滴定时盛放KMnO4溶液的仪器为________(填仪器名称)。
②判断此滴定实验达到终点的方法是_____________________________________。
③计算上述样品中FeSO4·7H2O的质量分数为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2.3 g钠在干燥的空气中与O2反应后,可得3.5 g固体,据此可判断其生成物为( )
A.只有Na2O2 B.只有Na2O
C.Na2O2和Na2O D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com