
【题目】有研究表明,内源性H2S作为气体信号分子家族新成员,在抗炎、舒张血管等方面具有重要的生理作用,而笼状COS(羰基硫)分子可作为H2S的新型供体(释放剂)。试回答下列有关问题
(1)COS的分子结构与CO2相似,COS的结构式为______。
(2)已知:①COS(g)+H2(g)H2S(g)+CO(g)△H1=-15kJmol-1,②COS(g)+H2(g)H2S(g)+CO2(g)△H2=-36kJmol-1,③CO(g)+H2O(g)H2(g)+CO2(g)△H3,则△H=______。
(3)COS可由CO和H2S在一定条件下反应制得。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g)COS(g)+H2(g),数据如表所示、据此填空
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | x |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应为______(选填“吸热反应”或“放热反应”)。
②实验2达到平衡时,x______7.0(选填“>”、“<”或“=”)
③实验3达到平衡时,CO的转化率α=______
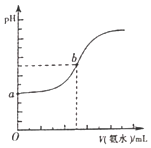
(4)已知常温下,H2S和NH3H2O的电离常数分别为向pH=a的氢硫酸中滴加等浓度的氨水,加入氨水的体积(V)与溶液pH的关系如图所示:
酸/碱 | 电离常数 | |
H2S | Ka1=1.0×10-7 | Ka2=7.0×10-15 |
NH3H2O | Kb=1.0×10-5 | |
①若c(H2S)为0.1mol/L,则a=______
②若b点溶液pH=7,则b点溶液中所有离子浓度大小关系是______。
(5)将H2S通入装有固体FeCl2的真空密闭烧瓶内,恒温至300℃,反应达到平衡时,烧瓶中固体只有FeCl2和FeSx(x并非整数),另有H2S、HCl和H2三种气体,其分压依次为0.30P0、0.80P0和0.04P0(P0表示标准大气压)。当化学方程式中FeCl2的计量数为1时,该反应的气体压强平衡常数记为Kp。计算:
①x=______(保留两位有效数字)。
②Kp=______(数字用指数式表示)。
【答案】O=C=S 21kJmol-1 放热反应 < 20% 4 c(NH4+)>c(HS-)>c(H+)=c(OH-)>c(S2-) 1.1 ![]()
【解析】
(1)CO2和COS是等电子体,等电子体结构相似,根据二氧化碳的分子的结构式可知COS结构式;
(2)根据盖斯定律计算可得;
(3)①分别建立三段式计算实验1和实验3的化学平衡常数,依据平衡常数的大小判断反应时放热还是吸热;
②通过浓度熵与平衡常数的大小判断平衡移动方向;
③依据三段式和转化率公式计算;
(4)①依据电离常数公式计算;
②依据电离程度和水解程度的相对大小判断;
(5)依据题给信息写出反应的化学方程式,由题给数据和公式计算即可。
(1)由二氧化碳分子的结构式可知:COS分子中C与O、C与S均形成两对共有电子对,所以COS结构式为:O=C=S,故答案为:O=C=S;
(2)盖斯定律②-①得到CO(g)+H2O(g)H2(g)+CO2(g)的焓变△H3=-36kJmol-1-(-15kJmol-1)=-21kJmol-1,故答案为:-21kJmol-1;
(3)设容器体积为1L。
①由题意可建立实验1反应的三段式为:
CO(g)+H2S(g)COS(g)+H2(g)
开始(mol/L)10.010.000
反应(mol/L)3.0 3.0 3.0 3.0
平衡(mol/L)7.0 7.0 3.0 3.0
化学平衡常数=![]() =
=![]() =0.18;
=0.18;
由题意可建立实验3反应的三段式为:
CO(g)+H2S(g)COS(g)+H2(g)
开始(mol/L) 20.0 20.0 0 0
反应(mol/L) 4.04.04.0 4.0
平衡(mol/L) 16.016.0 4.0 4.0
化学平衡常数=![]() =
=![]() =0.0625<0.18,所以升高温度,平衡常数k减小,即平衡逆向移动,正向即放热反应,故答案为:放热反应;
=0.0625<0.18,所以升高温度,平衡常数k减小,即平衡逆向移动,正向即放热反应,故答案为:放热反应;
②150℃,浓度熵Qc=![]() =
=![]() ≈0.16<k=0.18,则反应向正反应方向移动,所以实验2达平衡时,n(CO)减小,x<7.0,故答案为:<;
≈0.16<k=0.18,则反应向正反应方向移动,所以实验2达平衡时,n(CO)减小,x<7.0,故答案为:<;
③实验3达平衡时,CO的转化率=![]() ×100%=
×100%=![]() ×100%=20%,故答案为:20%;
×100%=20%,故答案为:20%;
(4)①c(H+)=![]() =
=![]() mol/L=10-4mol/L,a=pH=-lg10-4=4,故答案为:4;
mol/L=10-4mol/L,a=pH=-lg10-4=4,故答案为:4;
②b点呈中性,则c(H+)=c(OH-),溶液中电荷关系为c(NH4+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),所以c(NH4+)>c(HS-),由于HS-的电离程度很小、主要以电离为主,同时促进水的电离,所以c(H+)>c(S2-),即b点时溶液中所有离子浓度大小关系是c(NH4+)>c(HS-)>c(H+)=c(OH-)>c(S2-),故答案为:c(NH4+)>c(HS-)>c(H+)=c(OH-)>c(S2-);
(5)H2S和FeCl2反应的方程式为xH2S(g)+FeCl2(s)FeSx(s)+2HCl(g)+(x-1)H2(g)。
①有化学方程式可得关系式:2:(x-1)=0.80P0:0.04P0,解得x=1.1,故答案为:1.1;
②H2S和FeCl2反应的方程式为1.1H2S(g)+FeCl2(s)FeS1.1(s)+2HCl(g)+0.1H2(g),由方程式可得p(HCl)=0.80P0,p(H2)=0.04P0,p(H2S)=0.30P0,平衡分压常数Kp=![]()
=![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】一种芳纶纤的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图所示:
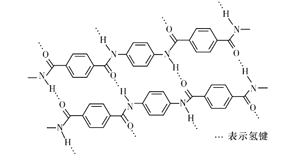
下列关于该高分子的说法不正确的是
A. 芳纶纤维可用作航天、航空、国防等高科技领域的重要基础材料
B. 完全水解产物的单个分子中,含有官能团一COOH或一NH2
C. 氢键对该高分子的性能有影响
D. 结构简式为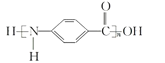
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成医药中间体X和Y。
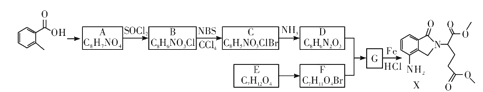
已知:①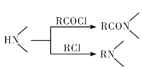 ;
;
②![]() ;
;
③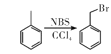 。
。
(1) 的名称是__________
的名称是__________
(2)G→X的反应类型是_____________。
(3)化合物B的结构简式为_____________。
(4)下列说法不正确的是__________(填字母代号)
A. 化合物A能使酸性KMnO4溶液褪色
B.化合物C能发生加成、取代、消去反应
C.化合物D能与稀盐酸反应
D.X的分子式是C15H16N2O5
(5)写出D+F→G的化学方程式:____________________
(6)写出化合物A(C8H7NO4)同时符合下列条件的两种同分异构体的结构简式_______。
①分子是苯的二取代物,1H—NMR谱表明分子中有4种化学环境不同的氧原子;
②分子中存在硝基和![]() 结构。
结构。
(7)参照以上合成路线设计E→![]() 的合成路线(用流程图表示,无机试剂任选)。
的合成路线(用流程图表示,无机试剂任选)。
____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从香荚兰豆中提取的一种芳香化合物,其分子式为C8H8O3,遇FeCl3溶液会呈现特征颜色,能发生银镜反应。该化合物可能的结构简式是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科。下列实验装置和方案能达到相应目的是( )
A. 图装置 ,加热蒸发碘水提取碘
,加热蒸发碘水提取碘
B. 图装置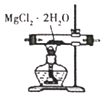 ,加热分解制得无水Mg
,加热分解制得无水Mg
C. 图装置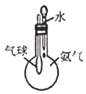 ,验证氨气极易溶于水
,验证氨气极易溶于水
D. 图装置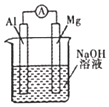 ,比较镁、铝的金属性强弱
,比较镁、铝的金属性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是__,画出配合物离子[Cu(NH3)4]2+中的配位键__.
(2)根据VSEPR模型,H3O+的分子立体结构为__,BCl3的立体结构为__.
(3)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式(各写一种)
正四面体分子__,三角锥形分子__,V形分子______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2==4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,单位都为mol/(Ls),则正确的关系是
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于__________(填 “晶体”或“非晶体”),可通过__________方法鉴别。
(2)基态Ni2+的核外电子排布式为__________;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于__________晶体;Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO__________FeO(填“<”或“>”)。
Ⅱ、判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示
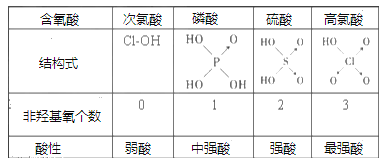
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3只有弱酸性。由此可推出亚磷酸的结构式为___________。从分子结构角度,简述二者酸性强弱原因_____________________。
(2)亚磷酸与过量的氢氧化钠溶液反应的化学方程式为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新冠病毒爆发期间,各类消毒剂大显身手,ClO2泡腾片就是一种,使用时将其投入水中即可产生ClO2对水体、环境消毒。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应:2NaClO2+Cl2=2ClO2+2NaCl。如图是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。


(1)仪器P的名称是__。
(2)写出装置A中烧瓶内发生反应的离子方程式__。
(3)B装置中所盛试剂是__。
(4)F为ClO2收集装置,应选用的装置是__(从①②③中选择),其中与E装置导管相连的导管口是__(填导管口的字母)
(5)相同条件下,ClO2的消毒能力是Cl2的__倍(以等物质的量的消毒剂得电子的数目计算)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com