
| 物质 | 粒子数(个) | 质量(g) | 物质的量(mol) | 摩尔质量(g/mol) |
| 氦气 | 0.3 | |||
| S | 1.204×1023 | |||
| CO2 | 22 | |||
| C12H22O11 | 0.25 |
分析 结合N=nNA、m=nM计算.
解答 解:氦气的摩尔质量为4g/mol,物质的量为0.3mol时其质量为0.3mol×4g/mol=1.2g,粒子数为0.3×6.02×1023=1.806×1023;
S的摩尔质量为32g/mol,粒子数为1.204×1023,物质的量为$\frac{1.204×1{0}^{23}}{6.02×1{0}^{23}}$=0.2mol,其质量为0.2mol×32g/mol=6.4g;
CO2的摩尔质量为44g/mol,质量为22g,物质的量为$\frac{22g}{44g/mol}$=0.2mol,粒子数为0.2×6.02×1023=1.204×1023;
C12H22O11的摩尔质量为342g/mol,物质的量为0.25mol时其质量为0.25mol×342g/mol=85.5g,粒子数为0.25×6.02×1023=1.505×1023;
故答案为:
| 物质 | 粒子数(个) | 质量(g) | 物质的量(mol) | 摩尔质量(g/mol) |
| 氦气 | 1.806×1023 | 1.2 | 4 | |
| S | 6.4 | 0.2 | 32 | |
| CO2 | 1.204×1023 | 0.2 | 44 | |
| C12H22O11 | 1.505×1023 | 85.5 | 342 |
点评 本题考查物质的量的计算,为高频考点,把握物质的量为中心的计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
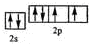 ,该元素的名称是氧.
,该元素的名称是氧.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热到100℃时,水的pH=6 | B. | 向水中滴加少量稀H2SO4 | ||
| C. | 向水中加入少量NaHCO3 | D. | 向水中加入少量胆矾晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 若铜片为51.2 g,则生成0.2 mol NaNO3 | |
| B. | 常温下,Cu 遇浓硝酸发生钝化,不可能发生上述反应 | |
| C. | 标准状况下收集的氮氧化物为20.16 L | |
| D. | 反应过程中生成的Cu(NO3)2 既是氧化产物,也是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;元素e的电子排布式为1s22s22p63s23p5,c的离子结构示意图为
;元素e的电子排布式为1s22s22p63s23p5,c的离子结构示意图为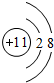
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中少量金属钠通常保存在煤油中 | |
| B. | 光线通过时,胶体可产生丁达尔效应 | |
| C. | 氧气、液氯是单质,氯水、氯化氢、纯碱是化合物. | |
| D. | “只要工夫深,铁杵磨成针”只涉及物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响.
某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com