
| A. | NH3 | B. | NO | C. | NO2 | D. | Cl2 |
分析 据能使湿润的红色石蕊试纸变蓝的气体是碱性气体氨气来回答.
解答 解:能使湿润的红色石蕊试纸变蓝说明该气体显碱性.
A、氨气有刺激性气味,氨气溶于水形成氨水,属于弱碱,氨气显碱性,能使湿润的红色石蕊试纸变蓝,故A正确;
B、一氧化氮属于中性气体,和水不反应,所以氮气不能使湿润的红色石蕊试纸变色,故B错误;
C、二氧化氮属于酸性气体,能使湿润的红色石蕊试纸变红,后褪色,故C错误;
D、氯气属于酸性气体,能使湿润的红色石蕊试纸变红,生成次氯酸具有漂白性,后褪色,故D错误;
故选A.
点评 本题考查物质的性质,解答本题的关键是要知道能使湿润的红色石蕊试纸变蓝,说明显碱性,氨气是中学学习的唯一一种碱性气体,题目较简单.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{2}{5}$mol | B. | $\frac{4}{5}$mol | C. | $\frac{6}{5}$mol | D. | $\frac{22}{5}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 20℃ | K2CO3 | KHCO3 | K2MnO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
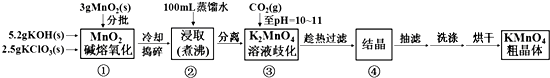
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1mol•L-1的NaHCO3溶液中含有阳离子的物质的量为0.2mol | |
| B. | 0.1 mol水蒸气在标准状况下体积为2.24 L | |
| C. | 在25℃,1.01×105Pa时,11.2 L氧气所含的氧原子数目为6.02×1023 | |
| D. | 标准状况下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝元素是在地壳中含量最高的金属元素,储量丰富 | |
| B. | 常温下可以用铝罐盛装浓硫酸 | |
| C. | 铝的冶炼技术基本成熟,可以大量生产 | |
| D. | 从金属活动性顺序来看铝是比较活泼的金属,所以铝丝加热可以在空气中剧烈燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | 烧碱溶液 | C. | 液氨水 | D. | KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)=c(SO42-) | B. | c(NH4+)=2c(SO42-) | ||
| C. | 2c(NH4+)=c(SO42-) | D. | c(OH-)+c(SO42-)=c(H+)+c(NH4+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com