
【题目】下列各组离子能在指定溶液中大量共存的是
①无色溶液中:K+、Cl、Al3+、AlO2-、SO42-
②常温下,pH=14 的溶液中:CO32-、Na+、S2-、AlO2-
③室温下水电离的 c(H+)=10-13mol·L-1 的溶液:K+、HCO3-、Br-、Ba2+
④加入Al能放出H2的溶液中:NO3-、Cl-、Na+、SO42-
⑤中性溶液中:Cl-、NO3-、Na+、Fe3+
⑥室温下![]() =1012 的溶液中:Fe2+、Al3+、SO42-、I-.
=1012 的溶液中:Fe2+、Al3+、SO42-、I-.
A.①③⑥B.②④⑤C.②⑥D.①③④
【答案】C
【解析】
①Al3+、AlO2-之间发生双水解反应,在溶液中不能大量共存,故①错误;
②常温下,pH =14的溶液呈碱性,溶液中存在大量氢氧根离子,CO32-、Na+、S2-、AlO2-
之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故②正确;
③室温下水电离的c(H+)=1013mol/L的溶液呈酸性或碱性,HCO3-在酸性或碱性条件下都不能共存,故③错误;
④加入 Al 能放出 H2 的溶液或是酸性或是碱性,在酸性环境下,H+、NO3-与Al发生反应,得不到H2,因此在酸性环境下,不能大量共存;故④错误;
⑤中性溶液中Fe3+要发生水解,故⑤错误;
⑥室温下![]() =1012的溶液呈酸性,Fe2+、Al3+、SO42-、I-离子之间不发生反应,可以共存,故⑥正确;
=1012的溶液呈酸性,Fe2+、Al3+、SO42-、I-离子之间不发生反应,可以共存,故⑥正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
D. 对于2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以异丁烯为原料合成某二酸的合成路线如图:
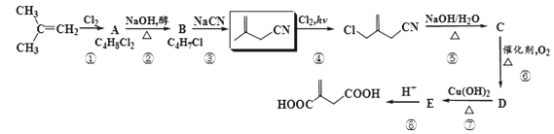
已知:R-CH2CN![]() R-CH2COONa+NH3
R-CH2COONa+NH3
(1)A的系统命名是__,B的官能团名称__。
(2)步骤③的反应类型是__。
(3)同一有机物中的两个同种官能团在反应时,一者参与反应占绝大多数,另一者几乎不反应,这被称之为“位置专一性”。请从反应物结构角度,简要解释步骤②中消去氯原子时的位置专一性:__。
(4)步骤⑤的产物C经酸化后,可发生分子内酯化,写出该内酯的结构简式___。
(5)写出步骤⑥的化学方程式__。
(6)均符合下列条件B的同分异构体为__。
a.所有碳原子一定共平面;b.核磁共振氢谱有3组峰。
(7)利用题目给的信息,写出由异丁烯为原料,两步合成![]() 的路线流程___。
的路线流程___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单斜硫和正交硫是硫的两种同素异形体。下列说法正确的是

A.S(s,单斜)═S(s,正交) ΔH3=-0.33 kJmol1
B.单斜硫比正交硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.①式表示断裂 1 mol O2 中的共价键所吸收的能量比形成 1 mol SO2 中的共价键所放出的能量多 297.16 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸锌[Zn(C6H11O7)2]是一种有机补锌剂,广泛应用于食药领域。已知葡萄糖酸锌能溶于水,易溶于热水,不溶于乙醇。某小组由葡萄糖制备葡萄糖酸锌的实验步骤如下:
I.制备葡萄糖酸(C6H12O7):
60℃水浴下,向一定体积葡萄糖溶液中滴入1%溴水至略过量,保温15 min。
II.制备葡萄糖酸钙[Ca(C6H11O7)2]:
将略过量CaCO3粉末缓慢加入上述溶液,在水浴中振荡,直至无气泡产生。过滤,冷却并加入等体积乙醇,产生沉淀。过滤,用乙醇洗涤固体,溶水待用。
III.制备葡萄糖酸锌粗品(装置如右,夹持、控温装置略):

在90℃水浴、搅拌下,向ZnSO4溶液中分批加入葡萄糖酸钙溶液。趁热过滤,向滤液中加入无水乙醇并冷却析晶,过滤。
请回答下列问题:
(1) 步骤I中溴水的作用是作______,判断溴水略过量的现象是______。
(2) 步骤II中用CaCl2代替CaCO3可行吗?______ (填“可行”或“不可行”),乙醇可洗去葡萄糖酸钙固体表面杂质,还具有______、______优点。
(3) 步骤III中,恒压滴液漏斗需要打开活塞______ (填“a”、“b”或“a和b”),90℃下,葡萄糖酸钙与硫酸锌发生反应的离子方程式为______。
(4) 葡萄糖酸锌粗品含少量难溶于水的杂质,纯化晶体的合理操作顺序是______ (选填写正确序号)。
① 蒸发浓缩至溶液表面出现晶膜;② 待晶体充分析出后,减压过滤;③ 将滤液冷却至室温,加入10 mL 95%乙醇溶液并搅拌,促进晶体析出;④ 趁热减压过滤,除去不溶物;⑤ 在50℃下用恒温干燥箱烘干,称重;⑥ 取烧杯加入10 mL蒸馏水,加热至微沸,加入粗品,得到葡萄糖酸锌饱和溶液。
(5) 测定产品纯度步骤如下:
取mg提纯后的产品溶于水配成100mL溶液,取25.00mL置于____中,加入V1mLc1mol·L-1Na2EDTA溶液(过量)和指示剂,用c2mol·L-1 Zn2+标准溶液滴定至终点,发生反应:Zn2++EDTA2—=Zn-EDTA,三次滴定平均消耗锌标准溶液V2mL,则该产品的纯度为______%(保留1个数字系数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:甲、乙、丙、丁为常见化合物,A、B为单质,相互转化关系如图。其中甲是天然气的主要成分。回答下列问题:
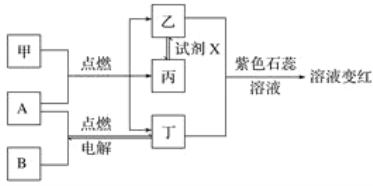
(1)丁物质的名称:______,丙物质的化学式:_________________________________________。
(2)检验化合物乙的化学方程式:___________________________________________________。
(3)试剂X可能的化学式:________、________(要求:所选物质类别不同)。
(4)通过分析表明:燃料充分燃烧的条件之一是______________________________。
(5)取变红溶液于试管中加热,观察到的现象有_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德常数的值,下列说法正确的是( )
A.24g镁的最外层电子数为NA
B.常温常压下,18g水含有的原子总数为3NA
C.标准状况下,11.2L乙醇中含有分子的数目为0.5NA
D.常温常压下,2.24L一氧化碳和二氧化碳混合气体中含有的碳原子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛,如图表示两个常见固氮反应的平衡常数对数值(lg K)与温度的关系:①N2+3H2![]() 2NH3,②N2+O2
2NH3,②N2+O2![]() 2NO。
2NO。

根据图中的数据判断下列说法正确的是( )
A.反应①和②均为放热反应
B.升高温度,反应①的反应速率减小
C.在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大
D.在1 000 ℃时,反应①和反应②体系中N2的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干洗衣服的干洗剂主要成分是四氯乙烯,家用不粘锅内侧涂覆物质的主要成分是聚四氟乙烯(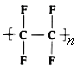 )。下列关于四氯乙烯和聚四氟乙烯的说法正确的是
)。下列关于四氯乙烯和聚四氟乙烯的说法正确的是
A.均为纯净物
B.都能发生加成反应,都能使酸性高锰酸钾溶液褪色
C.都属于不饱和烃,分子中都不含氢原子
D.四氯乙烯对油脂有较好的溶解作用,聚四氟乙烯的化学性质比较稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com