
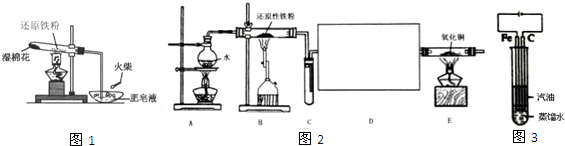
分析 (1)Fe粉与水蒸气在高温下反应生成Fe3O4和氢气;
(2)还原铁粉与水蒸气生成的氢气通入肥皂水会产生气泡;
(3)反应物为铁和水蒸气,图2中A用于制备水蒸气;
(4)氢气不与浓硫酸、碱石灰反应,可以用二者干燥,据此画出装置图;
(5)根据若铁粉剩余,铁粉能够将生成的铁离子还原为亚铁离子分析;
(6)铁为阳极,阳极Fe失去电子生成亚铁离子,阴极氢离子得到电子生成氢气,据此写出电极总反应.
解答 解:(1)Fe粉与水蒸气在高温下反应生成Fe3O4和氢气,方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)图1中若生成的气体会使肥皂泡上升,且点燃有爆鸣声,可以证明还原铁粉与水蒸气发生了反应,
故答案为:肥皂泡上升,点燃有爆鸣声;
(3)图1装置中湿棉花的作用是提供水,以便得到与铁粉反应的水蒸气,图2中装置A提供水蒸气,与湿棉花的作用相同,
故答案为:A;
(4)氢气为中性气体,可以用浓硫酸或碱石灰干燥,如装置①、②均可: ,
,
故答案为: ;
;
(5)实验结束,该同学取反应后装置B中固体混合物溶于足量稀硫酸,由于若反应后混合气体中还有未反应的铁粉,铁粉会将溶液中的Fe3+全部还原为Fe2+,即便滴加KSCN溶液也不会显红色,所以该说法不正确,
故答案为:不正确;如果反应后混合气体中还有未反应的铁粉,铁粉会将溶液中的Fe3+全部还原为Fe2+,即便滴加KSCN溶液也不会显红色;
(6)Fe与电源正极相连,为电解池的阳极,碳棒为阴极,阴极水电离的氢离子得到电子生成氢气,阳极铁失去电子生成亚铁离子,亚铁离子与氢氧根离子反应生成氢氧化亚铁沉淀,则实验中发现碳棒上冒气泡,蒸馏水中出现白色沉淀,发生反应为:Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2↓+H2↑,
故答案为:Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2↓+H2↑.
点评 本题考查了性质方案的设计,题目难度中等,明确实验目的为解答关键,注意熟练掌握铁及其化合物性质,试题培养了学生的分析、理解能力及化学实验能力.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污 | |
| B. | 氧化铝的熔点很高,可用于制作耐高温材料 | |
| C. | C12、SO2均有漂白性,可使紫色石蕊溶液褪色 | |
| D. | 钠的金属性强于钾,工业上可用钠制取钾Na+KCl$\frac{\underline{\;850℃\;}}{\;}$K↑+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应a为:2Fe3++2I-?2Fe2++I2 | B. | Ⅱ中,反应a进行的程度大于反应b | ||
| C. | 比较氧化性:Ⅱ中,I2>Fe3+ | D. | 比较水溶液中c(Fe2+):Ⅱ<Ⅲ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 松油醇的结构简式为 ,则其同分异构体可能属于醛类、酮类或芳醇类 ,则其同分异构体可能属于醛类、酮类或芳醇类 | |
| B. | 甲烷和氯气的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 分子式为C4H8O2且能与氢氧化钠溶液反应的有机物(不考虑立体异构和醛类物质)有6种 | |
| D. | 乙醇、乙酸均能与NaOH溶液反应,因为分子中均含有-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
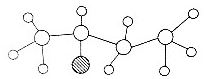
| A. | 该有机物肯定是的含烃氧衍生物 | |
| B. | 该有机物能发生取代反应和加成反应 | |
| C. | 该有机物可能是C4H9Cl | |
| D. | 该有机物可能与CH3CH2OCH2CH2互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
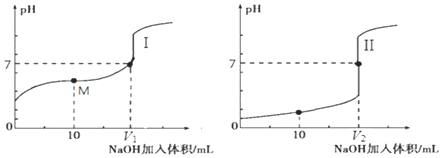
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,100 g 46%乙醇水溶液中含有H原子数为12Na | |
| B. | 23g Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为Na | |
| C. | 标准状况下,2.24 L CC14含有的共价鍵数为0.4Na | |
| D. | l molN2与4molH2反应生成的NH3分子数小于2Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com