
【题目】下列说法正确的是( )
A. HClO是弱酸,所以NaClO是弱电解质
B. 0.1 mol·L-1CH3COOH溶液的pH>1,可知CH3COOH溶液中存在CH3COOH![]() CH3COO-+H+
CH3COO-+H+
C. 能导电的物质一定是电解质
D. 弱电解质的电离程度越大,导电能力越强
【答案】B
【解析】A项,HClO是弱酸,NaClO溶于水完全电离,NaClO属于强电解质,错误;B项,0.1 mol·L-1CH3COOH溶液的pH>1,溶液中c(H+)![]() 0.1mol/L,则CH3COOH属于弱酸,在溶液中部分电离,电离方程式为CH3COOH
0.1mol/L,则CH3COOH属于弱酸,在溶液中部分电离,电离方程式为CH3COOH![]() CH3COO-+H+,正确;C项,能导电的物质不一定是电解质,如金属单质能导电,金属单质既不是电解质也不是非电解质,错误;D项,电解质溶液导电能力的强弱取决于溶液中离子物质的量浓度的大小和离子所带电荷数,与电离程度无关,如常温下CH3COOH的电离程度:0.01mol/LCH3COOH溶液
CH3COO-+H+,正确;C项,能导电的物质不一定是电解质,如金属单质能导电,金属单质既不是电解质也不是非电解质,错误;D项,电解质溶液导电能力的强弱取决于溶液中离子物质的量浓度的大小和离子所带电荷数,与电离程度无关,如常温下CH3COOH的电离程度:0.01mol/LCH3COOH溶液![]() 0.1mol/LCH3COOH溶液,但0.01mol/LCH3COOH溶液的导电能力弱于0.1mol/LCH3COOH溶液,错误;答案选D。
0.1mol/LCH3COOH溶液,但0.01mol/LCH3COOH溶液的导电能力弱于0.1mol/LCH3COOH溶液,错误;答案选D。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.Fe与S混合加热生成FeS2
B.NaHCO3的热稳定性大于Na2CO3
C.铁与硝酸反应后溶液中一定有Fe3+存在
D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是A、B两种重要的有机合成原料的结构。下列有关说法中正确的是
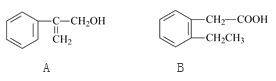
A. A与B互为同系物
B. A与B都能与溴的四氯化碳溶液发生加成反应
C. 在一定条件下,A与B均能发生取代反应
D. A与B都能与NaHCO3溶液反应产生CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查阅资料知:Br2的沸点为58.78℃,密度为3.119gcm﹣3,微溶于水,有毒。
Ⅰ.(1)常温下,单质溴通常呈__态,保存时通常在盛溴的试剂瓶中加入少量__液封。
Ⅱ.工业生产中,海水提取溴常用空气吹出法。其生产流程可用如图表示:
浓缩海水![]() 低浓度溴水
低浓度溴水![]() 含Br﹣的溶液
含Br﹣的溶液![]() 溴的浓溶液→液溴
溴的浓溶液→液溴
某化学实验小组模拟该法设计了如图实验装置(夹持装置略去)从浓缩的海水中提取液溴实验步骤如下:
①关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2,至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③关闭b,打开a,再通过A向B中通入足量的Cl2;
④将B中所得液体进行蒸馏,收集液溴。
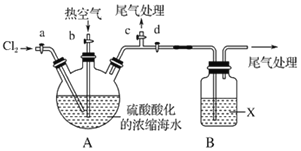
(2)当观察到A中液面上方出现____(实验现象)即可判断步骤①中反应已经结束。
(3)X试剂可以是___,尾气处理选用___(填序号,试剂不重复使用)。
a.H2O b.饱和食盐水 c.NaOH溶液 d.饱和Na2SO3溶液
B中X试剂发生反应的离子方程式为____________________________________。
(4)蒸馏时应该选择下列仪器_____(填序号),实验过程中应控制温度为_________时收集液溴。
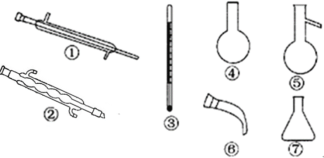
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:
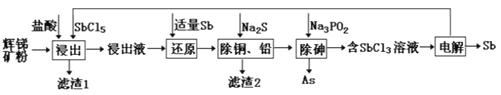
已知:①浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有___________(填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为_______________。
(3)“还原”时,被Sb还原的物质为___________(填化学式)。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于_________;所加Na2S也不宜过多,其原因为_____________________________。
(5)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为_________。
(6)一种突破传统电池设计理念的镁-锑液态金属储能电池工作原理如图所示:
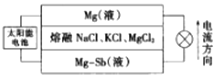
该电池由于密度的不同,在重力作用下分为三层,工作时中间层熔融盐的组成不变。充电时,Cl-向_____(填“上”或“下”)移动;放电时,负极的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则 ( )
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则 ( )
A. 平衡不移动
B. 再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C. 再达平衡时,C的体积分数增大
D. 再达平衡时,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.道尔顿提出原子学说
B.侯德榜发明了“侯氏制碱法”,改进了碳酸钠的制取工艺
C.舍勒首次制得金属钠
D.门捷列夫提出元素周期表
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:mA(g)+nB(?)![]() xC(g) △H,在不同温度及压强(p1,p2)条件下,反应物A的转化率如图所示,下列判断正确的是
xC(g) △H,在不同温度及压强(p1,p2)条件下,反应物A的转化率如图所示,下列判断正确的是
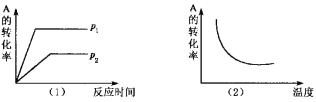
A. △H >0,m+n>x,同时B为非气态
B. △H >0,m+n<x,同时B为气态
C. △H <0,m+n>x,同时B为气态
D. △H <0,m<x,同时B为非气态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com