
| A. | 丙烯和氯气光照--取代 | |
| B. | 乙烯和溴水的反应--氧化 | |
| C. | 乙烯使酸性高锰酸钾溶液褪色--加成 | |
| D. | 乙烯水化法制乙醇--取代 |
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 白酒 | B. | 纯碱溶液 | C. | 食盐溶液 | D. | 柠檬酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成amolA2,同时消耗2a molAB | |
| B. | 容器内,3种气体AB、A2、B2共存 | |
| C. | 容器中各组分的体积分数不随时间变化 | |
| D. | AB的消耗速率等于A2的消耗速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
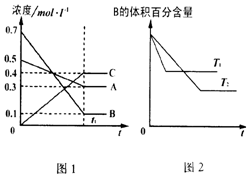
| A. | 在达平衡后,保持其他条件不变,增大压强,平衡向正反应方向移动 | |
| B. | 保持其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | |
| C. | T℃时,若由0.4mol•L -1A、0.4mol•L -1B、0.2mol•L -1C反应,达到平衡后,C的浓度为0.8mol•L -1 | |
| D. | 在达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | 分别将CuSO4、Na2CO3、KNO3、FeCl3的饱和溶液加热、蒸发后,仍能得到与原物质组成相同的晶体只有CuSO4、KNO3 | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 浓度均为0.1 mol•L-1的NaClO溶液和CH3COONa溶液中:阴离子的总浓度前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{Vρ}{22400}$mol•L-1 | B. | $\frac{V}{22.4}$mol•L-1 | ||
| C. | $\frac{Vρ}{22400+17V}$mol•L-1 | D. | $\frac{1000Vρ}{22400+17V}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
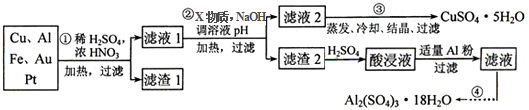
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com