
| A. | ①③⑤ | B. | ②⑤ | C. | ③④ | D. | ①②③④⑤ |
分析 ①地沟油主要成分为油脂,回收加工为生物柴油;
②电子垃圾中含有大量重金属,可导致重金属污染;
③燃煤进行脱硫脱硝,能够减少硫的氧化物和氮的氧化物的排放,防止酸雨的形成;
④含磷洗衣粉的使用能够引起水体的富营养化;
⑤可降解的生物农药能够减少对食品的污染.
解答 解:①地沟油”,是一种质量极差、极不卫生的非食用油,将地沟油回收加工为生物柴油,可以提高资源的利用率,故正确;
②电子垃圾中含有大量重金属,可导致重金属污染,不能从国外进口,故错误;
③煤燃烧时会产生硫的氧化物和氮的氧化物能够污染环境,对燃煤脱硫脱硝,可以减少环境污染,该选项说法正确,故正确;
④三聚磷酸钠会使水体中磷元素过剩,引起水体富营养化,造成水体污染,故错误;
⑤易降解的生物农药能减少污染物的排放,对环境污染小,适合于在未来有害生物综合治理中的应用,故正确;
故选:A.
点评 本题考查了环境污染与治理,熟悉生活中常见的环境污染是解题关键,注意培养绿色化学的理念.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 方法(或操作) | 原理 |
| A | 分离溶于水中的溴 | 裂解汽油萃取 | 碘在裂解汽油中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 从蛋清中提取蛋白质 | 加入硫酸铜溶液 | 浓盐溶液使蛋白质溶解度降低 |
| D | 尿液中尿糖的检验 | 加入新制Cu(OH)2、加热 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的第一电离能越大,其金属性越强 | |
| B. | 元素的第一电离能越小,其金属性越强 | |
| C. | 金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关 | |
| D. | 同周期元素,第一电离能随原子序数增大逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{蒸发}{→}$无水AlCl3 | |
| B. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$Fe | |
| C. | NaOH(aq)$\stackrel{CuSO_{4}(aq)}{→}$Cu(OH)2$→_{△}^{葡萄糖}$Cu2O | |
| D. | NH3$→_{催化剂}^{O_{2},△}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的醋酸溶液稀释100倍后,溶液的pH=5 | |
| B. | pH=2的盐酸与等体积0.01 mol?L-1醋酸钠混合溶液后,溶液中c(Cl-)=c(CH3COO-) | |
| C. | 氨水中通入过量CO2后,溶液中c(H+)+c(NH4+)=c(OH-)+c(HCO3-) | |
| D. | 0.1mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)>c(I-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
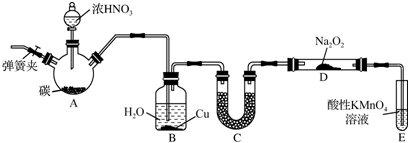
 铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:
铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3已部分氧化 | |
| B. | 加入硝酸钡溶液生成的沉淀一定含BaSO4 | |
| C. | 加入硝酸后的沉淀一定含BaSO3 | |
| D. | 此实验不能确定Na2SO3是否部分氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
 是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60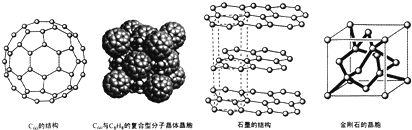
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com