
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为_________________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是__________________________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
(1)2CH4(g)+O2(g)===2CO(g)+4H2(g) ΔH=-46 kJ·mol-1
(2)①CH4 O2+2H2O+4e-===4OH- ②变小 不变 ③CO32— ④1.12
【解析】 (1)根据盖斯定律,将第一个热化学方程式乘以2,与第二个相加得2CH4(g)+O2(g)===2CO(g)+4H2(g) ΔH=-46 kJ·mol-1。
(2)由于Fe棒上镀Cu,则Cu棒发生氧化反应,作阳极,b电极作正极,a电极作负极,CH4在a处通入,O2在b处通入,由于KOH溶液作电解质溶液,则b极反应式为O2+2H2O+4e-===4OH-,电镀过程中电解质溶液不参与电极反应,各离子浓度均不变;CH4燃料电池中的化学方程式为CH4+2O2+2KOH===K2CO3+3H2O,可得溶液中存在CO32—,再由电子守恒得CH4~4Cu,则12.8 g Cu的物质的量为0.2 mol,消耗CH4为0.2/4=0.05 mol,在标准状况下的体积为0.05 mol×22.4 L·mol-1=1.12 L。


科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第2讲化学常用计量练习卷(解析版) 题型:填空题
某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25%NaClO 1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________ mol·L-1。
(2)该同学取100 mL该“84消毒液”稀释后用于消毒,稀释后的溶液中
c(Na+)=________ mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)某实验需用480 mL含25%NaClO的消毒液。该同学参阅该“84消毒液”的配方,欲用NaClO固体配制该消毒液。
①下列说法正确的是________。

A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
②在配制过程中,下列操作可能使配制的溶液的浓度偏大的是________。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第11讲有机化学基础练习卷(解析版) 题型:填空题
某芳香烃A可以从煤干馏得到的煤焦油中分离出来,以A为原料可以合成聚邻氨基苯甲酸、扁桃酸等物质,其合成流程如下。

已知:
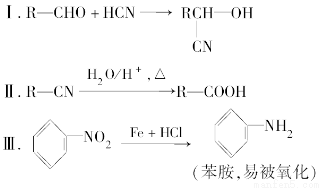
请回答下列问题:
(1)C的分子式为________。
(2)下列对相关反应类型的判断合理的是________(填序号)。
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
Ⅰ | 加成 | 水解 | 还原 | 取代 | 还原 | 氧化 | 加聚 |
Ⅱ | 加成 | 消去 | 还原 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅲ | 取代 | 水解 | 氧化 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅳ | 取代 | 消去 | 氧化 | 取代 | 还原 | 氧化 | 加聚 |
(3)写出反应③的化学方程式:_____________________________________。
(4)扁桃酸有多种同分异构体,其中既能与氯化铁溶液发生显色反应,又能与碳酸氢钠溶液反应产生气泡的同分异构体有________种,写出其中一种的结构简式:________。
(5)以芳香烃A为主要原料,还可以通过下列合成路线合成阿司匹林和冬青油:

①冬青油的结构简式为__________________________________________。
②写出反应Ⅴ的化学方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题9常见金属元素及其重要化合物练习卷(解析版) 题型:填空题
下列转化关系中,X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A呈红棕色,C、D、E是中学常见的三种化合物。分析转化关系回答问题:

(1)请写出反应①的化学方程式_____________________________________。
(2)检验D溶液中Y离子的方法是__________________________________。
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式______________________________。
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制取高效净水剂Y(OH)SO4,已知还原产物为NO,则该反应的化学方程式是________________________________________。
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 m3,则阴极产物的质量为________kg。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题9常见金属元素及其重要化合物练习卷(解析版) 题型:选择题
下列类比关系正确的是( )。
A.钠与氧气在不同条件下反应会生成两种不同的氧化物,则Li与氧气反应也能生成Li2O或Li2O2
B.Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应可生成Na2SO3和O2
C.Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3
D.Al与Fe2O3能发生铝热反应,则Al与MnO2也能发生铝热反应
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题8电化学原理练习卷(解析版) 题型:选择题
利用如图装置可以模拟铁的电化学防护。下列叙述正确的是 ( )。

A.铁被腐蚀过程实质是金属铁发生了还原反应
B.若X为锌片,开关K置于M处,可减缓铁的腐蚀
C.若X为碳棒,开关K置于M处,可减缓铁的腐蚀
D.当K置于N处时,可减缓铁的腐蚀
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题7电解质溶液练习卷(解析版) 题型:填空题
某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB- H++B2-。回答下列问题。
H++B2-。回答下列问题。
(1)Na2B溶液显_____(填“酸性”、“中性”或“碱性”),理由是_______(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是____。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能____0.11 mol·L-1(填“<”、“>”或“=”),理由是_____。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_______。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是 ( )。
2Z(g)一定达到化学平衡状态的是 ( )。
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题2常用化学计量--物质的量练习卷(解析版) 题型:选择题
在T ℃时,将a gNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含有NH的物质的量为b mol。下列叙述中正确的是( )。
A.溶质的质量分数为w= ×100%
×100%
B.溶质的物质的量浓度c= mol·L-1
mol·L-1
C.溶液中c(OH-)= mol·L-1
mol·L-1
D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5 w
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com