
【题目】在下列反应中,硫元素表现出氧化性的是:
A. 稀硫酸和锌粒反应B. 二氧化硫和氧气反应
C. 浓硫酸和铜反应D. 二氧化硫和水反应
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在周期表中1~36号之间的W、X、Y、Z、Q五种元素,它们的原子序数依次增大, 已知W与其余四种元素既不同周期也不同主族;X和Z的基态原子的核外电子均排布在3个能级上,且均有2个未成对电子;Q元素原子质子数为29。
(1)按电子排布,Q元素在周期表中属____________区。
(2)第一电离能Y______Z,电负性Y______Z(填“>”,“=”或“<”)。
(3)W与Z形成的常见化合物有W2Z、W2Z2;W与Y能形成多种二元化合物,如YW3、Y2W4、Y3W5、Y4W6……,W2Z分子中Z原子的杂化类型为______,YW3分子的立体构型为_____,YW3极易溶于W2Z的主要原因有___________________。(写出两点即可)
(4)Q+基态核外电子排布式为________________________________。
(5)Q+与Y3-形成的晶胞结构如图所示,阴、阳离子间的核间距为 a pm,阿伏加德罗常数用NA 表示,则晶体的密度为_____________g·cm-3。
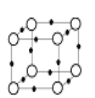
o-Y3- -Q+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应HCl作还原剂的是
A.CaCO3+2HCl=CaCl2+CO2↑+H2O
B.NaOH+HCl=NaCl+H2O
C.Zn+2HCl=ZnCl2+H2↑
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格氏试剂RMgX由Mg和卤代烃RX在干燥下的乙醚中反应制得,广泛用于复杂有机物的合。下图是著名香料(![]() )的合成路线。
)的合成路线。

(1)写出反应Ⅰ的反应条件____,反应Ⅱ的反应类型为____,化合物C的名称是____。
(2)写出下列物质的结构简式: E____ , F____。
(3)写出苯 → C的化学方程式:____
(4)A有多种同分异构体,其中苯环上有两种化学环境氢的同分异构体(含-MgBr结构)有____种。
(5)设计原料(![]() )合成产物(
)合成产物( )的合成路线:____
)的合成路线:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知马尔氏盐晶体[(NH4)2Fe(SO4)2·6H2O]易溶于水,不溶于乙醇,受热易分解,是分析化学中的重要试剂。回答下列问题:
(1)马尔氏盐晶体的制备:
甲组同学利用新生成的硫酸亚铁溶液与硫酸铵溶液反应制备马尔氏盐晶体(已知所使用的铁屑中含有少量的Fe2O3和FeS杂质),装置如图所示;

①为了使A中所制得的FeSO4中不含Fe3+,应使______________________过量(填化学式)。
②实验前期,需要用生成的H2将装置中的空气排尽,其原因是______________________,装置B中的试剂为____________(填写试剂名称)。
③装置A中反应一段时间后,若不拆卸装置,如何使装置A中生成的FeSO4进入装置C中,叙述操作过程____________________________________________。
(2)验证马尔氏盐晶体分解的气态产物成分:
提出假设:马尔氏盐晶体分解可能生成H2O、NH3、SO3、___________等气态化合物。
实验验证:实验小组取一定量马尔氏盐晶体隔绝空气加强热分解,利用下列裝置检验气态产物的成分(防倒吸装置已略去),试完成下表:
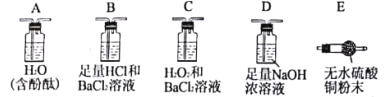
操作步骤 | 实验现象 | 结论 |
①按___→___→____顺序连接装置(填字母)。 | ②______________________ ______________________。 | 证明气体产物中含有H2O和NH3。 |
③按B→C→D顺序连接装置,其中装置B的作用是______________________。 | B中无明显现象,C中有白色沉淀生成。 | ④_____________________ ______________________。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝广泛应用于航空、建筑、汽车等行业,目前工业上采用电解氧化铝和冰晶石(Na3AlF6)混合物的方法制取铝。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图
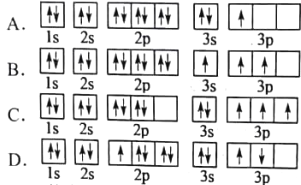
其中能量最低的是___________(填字母),电子由状态C到状态B所得原子光谱为___________光谱(填“发射”或“吸收”),状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合____________________________________________。
(2)熔融状态的氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。
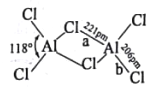
①a键的键能_________b键的键能(填“>”“<”或“=”),其理由是______________________。
②Al2Cl6中铝原子的杂化方式为___________;AlCl3的空间结构为 ___________________。
(3)冰晶石属于离子化合物,由Na+和AIF63-组成,在冰晶石的晶胞中,AlF63-占据的位置相当于氯化钠晶胞中Cl-的位置。
①冰晶石的化学式为___________,一个冰晶石晶胞中Na+的个数为___________。
②已知冰晶石的密度为2.95g/cm3,则冰品石晶胞的边长a=___________pm(列出算式即可,阿伏加德罗常数值为6.02×1023)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的一些问题常涉及到化学知识,下列叙述不正确的是( )
A.糯米中的淀粉一经发生水解反应,就酿造成酒
B.福尔马林是一种良好的杀菌剂,但不可用来消毒饮用水
C.棉花和人造丝的主要成分都是纤维素
D.室内装饰材料中缓慢释放出的甲醛、甲苯等有机物会污染空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,不溶于水和乙醚(易挥发的有机溶剂),微溶于乙醇,易溶于盐酸,其制备装置如下(已知:Cr3+水溶液颜色为绿色,Cr2+水溶液颜色为蓝色):

回答下列问题:
(1)装置甲中连通管a的作用是___________。
(2)向三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液:关闭K2打开K1,旋开分液漏斗的旋塞并控制好滴速;当观察到三颈烧瓶中溶液颜色由绿色完全转变为蓝色时,进行的实验操作为______________,从而将甲中溶液自动转移至装置乙中;当观察到装置乙中出现________________________时,说明反应基本完成,此时关闭分液漏斗的旋塞。
(3)装置乙中反应的离子方程式为_____________。
(4)将装置乙中混合物快速过滤、洗涤和干燥,称量得到mg[Cr(CH3COO)2]2·2H2O。其中洗涤的目的是去除可溶性杂质和水分,下列洗涤试剂正确的使用顺序是_____(填标号。
A.乙醚 B.去氧冷的蒸馏水 C.无水乙醇
(5)若实验所取用的CrCl3溶液中含溶质ng,则[Cr(CH3COO)2]2·2H2O(相对分子质量为376 )的产率是___________。
(6)该实验装置有一个明显的缺陷是________,解决此缺陷的措施为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com