
【题目】常温下,用0.1molL﹣1 NaOH溶液滴定20mL 0.1molL﹣1CH3COOH溶液的滴定曲线如图所示.下列说法正确的是( )
A.点①所示溶液中:c(Na+)>c(CH3COO﹣)>c(CH3COOH)>c(H+)>c(OH﹣)
B.点②所示溶液中:c(Na+)+c(H+)=c(CH3COO﹣)+c(CH3COOH)+c(OH﹣)
C.点③所示溶液中:c(CH3COO﹣)>c(Na+)>c(OH﹣)>c(H+)
D.在整个滴定过程中:溶液中 ![]() 始终不变
始终不变
【答案】D
【解析】解答:A.点①所示溶液中,滴入10mL氢氧化钠溶液,则反应后溶液中溶质为等浓度的醋酸钠和醋酸,由于醋酸的电离程度大于醋酸根离子的水解程度,溶液显示酸性,则:c(H+)>c(OH﹣)、c(CH3COO﹣)>c(CH3COOH),结合物料守恒可得:c(CH3COO﹣)>c(Na+)>c(CH3COOH),所以A错误;
B.点②所示溶液中一定满足电荷守恒:c(Na+)+c(H+)=c(CH3COO﹣)+c(OH﹣),则c(Na+)+c(H+)<c(CH3COO﹣)+c(CH3COOH)+c(OH﹣),所以B错误;
C.点③所示溶液中,氢氧化钠与醋酸恰好反应生成醋酸钠,醋酸根离子部分水解,溶液显示碱性,则:c(CH3COO﹣)<c(Na+)、c(OH﹣)>c(H+),溶液中离子浓度大小为:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+),所以C错误;
D. ![]() 为醋酸电离平衡常数的倒数,由于滴定过程中醋酸的电离平衡常数始终不变,则
为醋酸电离平衡常数的倒数,由于滴定过程中醋酸的电离平衡常数始终不变,则 ![]() 的值不变,所以D正确;所以选D.
的值不变,所以D正确;所以选D.
分析:本题考查了离子浓度大小比较、酸碱混合的定性判断,明确反应后溶液中的溶质组成为解答关键,注意掌握电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1mol/L,加入等体积0.3mol/L的BaCl2溶液恰好使SO42﹣完全沉淀,则混合溶液中Na+的浓度为( )
A.0.3 mol/L
B.0.45 mol/L
C.0.6 mol/L
D.0.15 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明SiO2是酸性氧化物的是 ( )
A.SiO2 + 3C = SiC + 2CO↑
B.SiO2 + 2NaOH = Na2SiO3 + H2O
C.SiO2 + 4HF = SiF4↑+ 2H2O
D.SiO2 + CaCO3 = CaSiO3 + CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是一种应用广泛的金属。下列有关铁的说法错误的是
A.铁与盐酸反应生成氯化铁与氢气B.常温下,铁在浓硫酸中会发生钝化
C.铁在氧气中燃烧生成四氧化三铁D.铁是一种银白色金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X为化学常见物质,它们的转化关系如图所示(反应条件未注明).请根据题中信息回答问题. 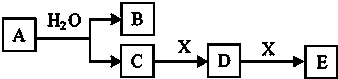
(1)若A为单质,E为白色难溶物且既能溶于盐酸又能溶于C溶液,则
①D与X发生反应的离子方程式为;
②常温下pH=10的C溶液与D溶液中,水的电离程度大(填C或D).
(2)若A为离子化合物,B为不溶于碱的白色难溶物,E与水反应生成的浓溶液G遇C有白烟产生,则
①A的化学式为;
②等物质的量浓度的G溶液与C溶液等体积混合,混合液中的质子守恒式为: . (用微粒浓度表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
A.原子半径:X<Y<Z
B.气态氢化物的稳定性:X>Z
C.最高价氧化物对应水化物的酸性:Y>W
D.Z、W均可与Mg形成离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com