
【题目】将![]() 持续通入下列八种饱和溶液:
持续通入下列八种饱和溶液:![]()
![]()
![]()
![]()
![]()
![]() 和NaCl
和NaCl![]() ,最终能得到沉淀、浊液或析出晶体的是
,最终能得到沉淀、浊液或析出晶体的是
A.②⑤⑧B.⑤⑥⑧C.①②③④⑦D.②③④⑧
【答案】C
【解析】
①过量的![]() 通入饱和
通入饱和![]() 溶液中发生反应生成碳酸氢钠,碳酸氢钠溶解性小于碳酸钠,所以有晶体碳酸氢钠析出,故正确;
溶液中发生反应生成碳酸氢钠,碳酸氢钠溶解性小于碳酸钠,所以有晶体碳酸氢钠析出,故正确;
②碳酸的酸性强于硅酸,向硅酸钾溶液中通入二氧化碳生成硅酸沉淀,故正确;
③NaAlO2溶液通入过量的二氧化碳,可生成氢氧化铝沉淀,故正确;
④碳酸的酸性强于苯酚,二氧化碳通入苯酚钠溶液生成苯酚沉淀,故正确;
⑤碳酸的酸性强于次氯酸,过量二氧化碳能够与次氯酸钙反应生成碳酸氢钙,碳酸氢钙易溶于水,故错误;
⑥碳酸的酸性弱于盐酸,与氯化钙不反应,不会产生沉淀,故错误;
⑦可生成碳酸氢钠和氯化铵,为侯氏制碱法原理,发生反应:![]() ,所以有
,所以有![]() 晶体析出,故正确;
晶体析出,故正确;
⑧过量的![]() 与
与![]() 反应生成碳酸氢钙和水,碳酸氢钙溶于水,故错误;
反应生成碳酸氢钙和水,碳酸氢钙溶于水,故错误;
①②③④⑦正确,故选C。


科目:高中化学 来源: 题型:
【题目】下列分子或离子中键角由大到小排列的是( )
①BCl3 ②NH3 ③H2O ④PCl4+ ⑤HgCl2
A.⑤④①②③B.⑤①④②③C.④①②⑤③D.③②④①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
(1)工业制硫酸铜的方法很多。
① 方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是________,此法的最大缺点是__________。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:

稀硫酸、铜和氧化铁反应的化学方程式是_________________;向混合溶液中通入热空气的反应的离子方程式是___________________;由滤液得到无水硫酸铜的实验操作是______________。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:

①吸收塔中发生反应的化学方程式是_______________________。
② 有数据表明,吸收塔中溶液的pH在5.5~6.0之间,生产效率较高。当控制一定流量的尾气时,调节溶液的pH的方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】373K时,某 1L密闭容器中加入2mol NH3发生如下可逆反应:2NH3(g)![]() N2(g)+3H2(g)。其中物质H2的物质的量变化如下图所示。
N2(g)+3H2(g)。其中物质H2的物质的量变化如下图所示。
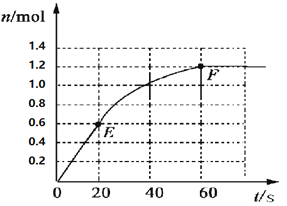
(1)前20 s内NH3(g)的平均反应速率为___________;
(2)373K时该反应的平衡常数的值为______________;
(3)若在此平衡体系中再加入1mol的NH3,与原平衡比较,新平衡时NH3的转化率______(填“增大”或“减小”,下同),NH3的平衡浓度_________。
(4)将原平衡升温至473K,重新达平衡时(其他条件不变),H2的平衡浓度为NH3的2倍,该反应的正反应为_________(填“放热反应”或“吸热反应”),为增大平衡体系中H2的物质的量,下列措施正确的是(其它条件相同)______。
a.升高温度 b.扩大容器的体积 c.加入合适的催化剂 d.再充入N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是工业上重要的还原性漂白剂,也是重要的食品抗氧化剂。某学习小组模拟工业流程设计实验制取保险粉。
已知:Na2S2O4是白色固体,还原性比Na2SO3强,易与酸反应(2S2O42-+4H+=3SO2↑+S↓+2H2O)。
(一)锌粉法
步骤1:按如图方式,温度控制在40~45℃,当三颈瓶中溶液pH在3~3.5时,停止通入SO2,反应后得到ZnS2O4溶液。
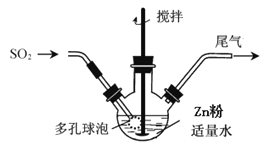
步骤2:将得到的ZnS2O4溶液加入NaOH溶液中,过滤,滤渣为Zn(OH)2,向滤液中加入一定量食盐,立即析出Na2S2O42H2O晶体。
步骤3:,经过滤,用乙醇洗涤,用120~140℃的热风干燥得到Na2S2O4。
(二)甲酸钠法
步骤4:按上图方式,将装置中的Zn粉和水换成HCOONa、Na2CO3溶液和乙醇。温度控制在70~83℃,持续通入SO2,维持溶液pH在4~6,经5~8小时充分反应后迅速降温45~55℃,立即析出无水Na2S2O4。
步骤5:经过滤,用乙醇洗涤,干燥得到Na2S2O4。
回答下列问题:
(1)步骤1容器中发生反应的化学方程式是______;容器中多孔球泡的作用是______。
(2)步骤2中“向滤液中加入一定量食盐,立即析出Na2S2O42H2O晶体”的原理是(用必要的化学用语和文字说明)______。
(3)两种方法中控制温度的加热方式是______。
(4)根据上述实验过程判断,Na2S2O4在水、乙醇中的溶解性为:______。
(5)甲酸钠法中生成Na2S2O4的总反应为______。
(6)两种方法相比较,锌粉法产品纯度高,可能的原因是______。
(7)限用以下给出的试剂,设计实验证明甲酸钠法制得的产品中含有Na2SO4。
稀盐酸、稀硫酸、稀硝酸、AgNO3溶液、BaCl2溶液______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A. 放电时负极附近溶液的碱性不变
B. 充电过程是化学能转化为电能的过程
C. 充电时阳极反应:Ni(OH)2-e-+ OH-=NiOOH + H2O
D. 放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 工业制硫酸中,在矿石处理阶段,将矿石粉碎再煅烧 | 增大反应物的接触面积,加快化学反应速率 |
B | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入MnO2,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
C | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
D | 一定条件下:H2(g)+I2(g) | c(I2)增大,I2物质的量增多 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用10mL H2O2制取150mLO2所需的时间(秒)
| 30% H2O2 | 15% H2O2 | 10% H2O2 | 5% H2O2 |
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360 | 480 | 540 | 720 |
MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
①该研究小组在设计方案时。考虑了浓度、___________、____________等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?_______________________。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%(密度为1.0g/cm3)的双氧水中,并用带火星的木条测试。测定结果如下:
实验 序号 | 催化剂(MnO2) | 操作 情况 | 观察结果 | 反应完成 所需的时间 |
A | 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 5span>分钟 |
B | 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
① 写出H2O2发生分解的化学反应方程式________________。求出实验A中H2O2在5分钟内的平均反应速率________________。(结果保留小数点后两位数字)
② 实验结果说明催化剂作用的大小与____________________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920 kJB.557 kJC.188 kJD.436 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com