
 ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.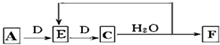
分析 X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,则Z为O元素;J元素的焰色反应呈黄色,则J为Na;Q的最外层电子数与其电子总数比为3:8,原子序数大于Na元素,故Z处于第三周期,则Q为S元素;X能与J形成离子化合物,且J+的半径大于X-的半径,可推知X为H元素;Y2是空气主要成分之一,原子序数小于氧,则Y为N元素.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)同周期自左而右原子半径减小,电子层越多原子半径越大;
(3)同主族自上而下非金属性减弱,可利用气态氢化物的稳定性、单质之间的置换反应来、元素相互化合时化合价等说明,物质状态属于物理性质,不能比较非金属性强弱;
(4)Q的氢化物H2S与它的低价氧化物SO2反应生成硫与水;
(5)X与Y可形成分子A为NH3,实验室利用氯化铵与氢氧化钙在加热条件下制备氨气;
(6)A为NH3,与D连续反应生成C,C与水反应得到E,则D为O2,E为NO、C为NO2、F为HNO3.
解答 解:X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,则Z为O元素;J元素的焰色反应呈黄色,则J为Na;Q的最外层电子数与其电子总数比为3:8,原子序数大于Na元素,故Z处于第三周期,则Q为S元素;X能与J形成离子化合物,且J+的半径大于X-的半径,可推知X为H元素;Y2是空气主要成分之一,原子序数小于氧,则Y为N元素.
(1)Q为S元素,原子核外有3个电子层、最外层电子数为6,处于周期表中第三周期ⅥA族,
故答案为:第三周期ⅥA族;
(2)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:Na>S>N>O>H,
故答案为:Na>S>N>O>H;
(3)O、S同主族自上而下非金属性减弱,故非金属性O>S;
a.H2S的水溶液放置在空气中会变浑浊,说明氧气能氧化硫化氢生成硫,则氧气的氧化性大于S,说明O元素非金属较强,故a正确;
b.S与O元素形成的化合物中S元素表现正化合价,O元素表现负化合价,氧原子对键合电子吸引力更大,故氧元素非金属性较强,故b正确;
c.单质状态属于物理性质,不能比较非金属性强弱,故c错误;
d.同主族自上而下非金属性减弱,故非金属性O>S,故d正确,
故答案为:>;c;
(4)Q的氢化物H2S与它的低价氧化物SO2反应的化学方程式为:2H2S+SO2=2H2O+3S↓;
故答案为:2H2S+SO2=2H2O+3S↓;
(5)X与Y可形成分子A为NH3,氨气的电子式为 ,实验室制备气体A的化学方程式:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,
,实验室制备气体A的化学方程式:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,
故答案为: ;2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
;2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(6)A为NH3,与D连续反应生成C,C与水反应得到E,则D为O2,E为NO、C为NO2、F为HNO3.
①C→F 的反应方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
②Cu的物质的量为$\frac{25.6g}{64g/mol}$=0.4mol,生成为Cu(NO3)2为0.4mol,生成NO、NO2的总物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,根据N元素守恒可知参加反应的HNO3为0.4mol×2+0.4mol=1.2mol,
故答案为:1.2mol.
点评 本题考查结构性质位置关系应用、元素化合物推断,注意掌握金属性、非金属性强弱比较实验事实,掌握中学常见的连续反应,(6)中注意利用守恒法计算,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丁烷也称异丁烷 | |
| B. | 溴水与苯发生取代反应而褪色 | |
| C. | C4H9Cl有4种同分异构体 | |
| D. | 蔗糖和麦芽糖水解的最终产物都是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7 mol | B. | 6 mol | C. | 5 mol | D. | 4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和C2H4 | B. | C2H4 和C5H8 | C. | C2H4 和C3H4 | D. | C2H4 和C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,1.42g Na2SO4含有的Na+离子数为0.01 NA | |
| C. | 通常状况下,NA个CO2分子含有原子数为3 NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径:Y>X>W | B. | 氢化物的沸点:W>X>Y | ||
| C. | 氢化物的稳定性:R>Y>X | D. | 简单阴离子的还原性:Y>R>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4CNO和CO(NH2)2 | B. | CH2OHCHO和CH3COOH | ||
| C. | CH3OOCCH3和CH3COOCH3 | D. | 甘氨酸和CH3 CH2NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com