
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,断开化学键吸收的能量大于形成化学键所放出的能量 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H=QKJ/mol |
分析 A.依据反应后醋酸凝固,说明反应是吸热反应;
B.吸热反应中,化学键断裂吸收的总能量大于化学键形成放出的总能量;
C、吸热反应中,反应物的总能量小于生成物的总能量;
D、吸热反应的反应热为正值,且应标注物质的状态.
解答 解:A.醋酸逐渐凝固说明反应吸收热量导致醋酸溶液温度降低,即NH4HCO3与HCl的反应为吸热反应,故A错误;
B、反应为吸热反应,从化学键的角度分析,化学键断裂要吸收能量,化学键形成要放出能量,则应有化学键断裂吸收的总能量大于化学键形成放出的总能量,故B正确;
C、此反应为吸热反应,故反应物的总能量小于生成物的总能量,故C错误;
D、吸热反应的反应热为正值,且应标注物质的状态,故此反应的热化学方程式应为:NH4HCO3(g)+HCl(aq)=NH4Cl(aq)+CO2↑(g)+H2O(l)△H=Q kJ/mol(Q>0),故D错误.
故选B.
点评 本题考查化学反应能量变化判断,热化学方程式书写方法,能量守恒的应用分析是解题关键,题目难度中等.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是从源头上减少和消除化工生产对环境的污染 | |
| B. | 减少化石燃料使用,有利于降低空气中PM2.5的值 | |
| C. | 淀粉、豆油、蛋白质都是天然高分子化合物 | |
| D. | “地沟油”禁止食用,但可以用来制肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
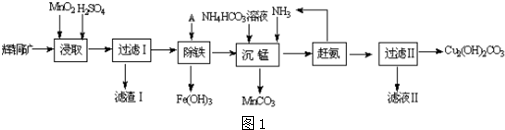
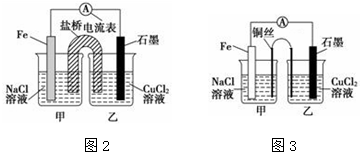
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| B. | 澄清石灰水中加少量碳酸氢钠:Ca2++OH-+HCO${\;}_{3}^{-}$═CaCO3↓+H2O | |
| C. | H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| D. | 碳酸钠的水解反应:CO${\;}_{3}^{2-}$+H3O+?HCO${\;}_{3}^{-}$+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人们可以把放热反应释放的能量转化为其它可利用的能量,而吸热反应没有利用价值 | |
| B. | 太阳能热水器、沼气的使用、玉米制乙醇都涉及生物质能的利用 | |
| C. | 地球上最基本的能源是化学能 | |
| D. | 利用二氧化碳制造全降解塑料能有效减少“白色污染” |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO、C2H2、N2 | |
| B. | SO2、NO${\;}_{2}^{+}$、N${\;}_{3}^{-}$、CNO- | |
| C. | CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、BeCl2 | |
| D. | SiF4、SiO${\;}_{4}^{4-}$、SO${\;}_{4}^{2-}$、PO${\;}_{4}^{3-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
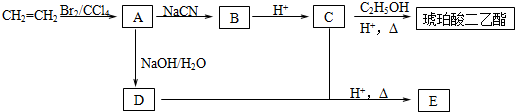
 +2nH2O.
+2nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com