
| A. | 甲烷和乙烯:分别通入酸性KMnO4溶液 | |
| B. | 乙醇和乙酸:分别滴加NaOH溶液 | |
| C. | 苯和四氯化碳:分别与水混合、振荡、静置 | |
| D. | 棉花织品和羊毛织品:分别燃烧闻气味 |
分析 A.乙烯可与高锰酸钾发生氧化还原反应;
B.乙醇溶于水,乙酸与氢氧化钠反应没有明显现象;
C.苯和四氯化碳都不溶于水,密度不同;
D.羊毛含有蛋白质,灼烧具有烧焦的羽毛气味.
解答 解:A.乙烯含有碳碳双键,可与高锰酸钾发生氧化还原反应,可鉴别,故A正确;
B.乙醇溶于水,乙酸与氢氧化钠反应没有明显现象,不能鉴别,故B错误;
C.苯和四氯化碳都不溶于水,密度不同,苯的密度比水小,四氯化碳的密度比水大,可鉴别,故C正确;
D.羊毛含有蛋白质,灼烧具有烧焦的羽毛气味,为蛋白质的特征性质,可鉴别,故D正确.
故选B.
点评 本题考查有机物的鉴别,为高频考点,把握有机物的性质、性质差异、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
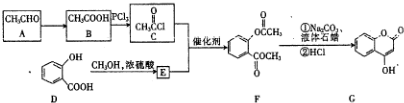
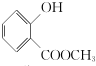 ,G中所含官能团的名称为酯基、碳碳双键、羟基;
,G中所含官能团的名称为酯基、碳碳双键、羟基;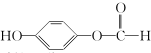 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
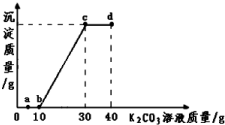
| A. | 向a点对应的溶液中滴加无色酚酞试液,溶液为无色 | |
| B. | 该温度下,K2CO3的溶解度为100g | |
| C. | 由图象可得,10g该溶液中氯化钙的质量约为8g | |
| D. | b、c、d三点对应的溶液中分别含有两种溶质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气 二氧化碳 氢氧化钠 | B. | 氯化钠 过氧化钠 氯化铵 | ||
| C. | 氯化钠 过氧化氢 氯化铵 | D. | 氯化钠 氦气 氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是该反应在不同温度下的平衡常数:
铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是该反应在不同温度下的平衡常数:| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 在酸性条件下,用H2O2将I-氧化为I2:H2O2+2I-+2H+=I2+2H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | NaHCO3溶液中加入少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com