
| A. | 活性炭具有还原性,可用作冰箱除味剂 | |
| B. | 二氧化硫具有氧化性,可用作造纸漂白剂 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板 |
分析 A.用活性炭作冰箱的除味剂是利用活性炭的吸附性;
B.用二氧化硫漂白纸张是利用二氧化硫的漂白性;
C.氧化铝属于两性氧化物,能溶于强酸和强碱溶液;
D.Cu能将铁离子还原为亚铁离子.
解答 解:A.用活性炭作冰箱的除味剂是利用活性炭的吸附性,与活性炭的还原性无关,且该变化属于物理变化,故A错误;
B.用二氧化硫漂白纸张是利用二氧化硫的漂白性,与二氧化硫的氧化性无关,二氧化硫氧化硫化氢生成S的反应体现二氧化硫的氧化性,故B错误;
C.氧化铝属于两性氧化物,能溶于强酸和强碱溶液,熔融状态下氧化铝能溶于NaOH生成偏铝酸钠和水,所以不能用氧化铝坩埚熔融氢氧化钠,应该用Fe坩埚,故C错误;
D.Cu能将铁离子还原为亚铁离子,同时Cu被还原生成铜离子,所以氯化铁溶液能用于蚀刻印刷电路板,故D正确;
故选D.
点评 本题考查化学与生活,为高频考点,涉及氧化还原反应、物质性质等知识点,明确物质性质是解本题关键,熟练掌握常见物质的性质,题目难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
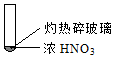 | 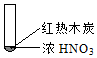 | 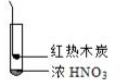 |
| ① | ② | ③ |
| A. | 由①中的红棕色气体,推断产生的气体一定是混合气体 | |
| B. | 红棕色气体不能表明②中木炭与浓硝酸产生了反应 | |
| C. | 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 | |
| D. | ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
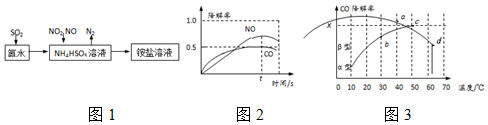
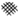 ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围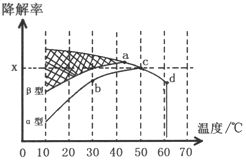 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作和现象 | 结论 |
| A. | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
| B. | 向电石中加入饱和食盐水制乙炔,并将产生的气体直接填入酸性高锰酸钾溶液中,溶液紫红色褪去 | 记明乙炔能被酸性高锰酸钾氧化 |
| C. | 常温下,测得饱和Na2S溶液的PH大于饱和Na2CO3溶液 | 常温下水解程度:S2->CO32- |
| D. | 向分液漏斗中加入碘水后再加入CCl4,充分振荡,分层,且上层溶液至紫色 | CC14可作为碘的萃取剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应N2 (g)+3H2 (g)?2NH3 (g)的△H<0,△S>0 | |
| B. | 地下钢铁管道用导线连接锌块可以减缓管道的腐蚀 | |
| C. | 常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4 mol•L-1 | |
| D. | 常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g•cm-3.实验室制备少量1-溴丙烷的主要步骤如下:
1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g•cm-3.实验室制备少量1-溴丙烷的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
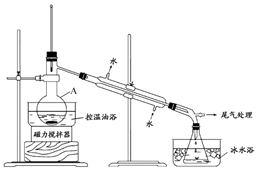
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
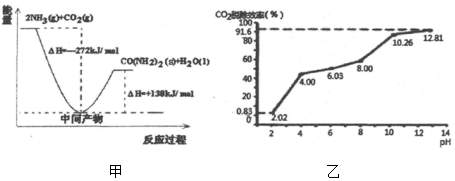
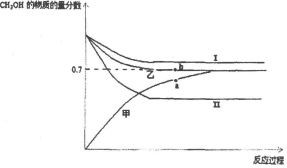
| 容器 | 甲 | 乙 | 丙 |
| 起始反应物投入量 | 2molH2、1molCO | 1molCH3OH | 2mol CH3OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com